题目内容
19.一种二次电池如图所示,该电池的电解质为强碱溶液,下列说法中正确的是( )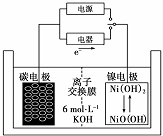
| A. | 充电时阴极发生氧化反应 | |
| B. | 充电时将碳电极与电源的正极相连 | |
| C. | 放电时碳电极反应为H2-2e -=2H+ | |
| D. | 放电时镍电极反应为NiO(OH)+H20+e-=Ni( OH)2+OH - |
分析 根据图片中电子流向知,放电时,石墨电极是负极,电极反应式为H2+2OH--2e-=2H2O,正极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,充电时阴阳极与放电时负极、正极反应式正好相反,据此分析解答.
解答 解:根据图片中电子流向知,放电时,石墨电极是负极,电极反应式为H2+2OH--2e-=2H2O,正极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,充电时阴阳极与放电时负极、正极反应式正好相反,
A.充电时,阴极上得电子发生还原反应,故A错误;
B.充电时,C电极作阴极,所以应该与电源负极相连,故B错误;
C.放电时,电解质溶液呈碱性,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2+2OH--2e-=2H2O,故C错误;
D.放电时镍电极是正极,正极上得电子发生还原反应,电极反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高考高频点,明确各个电极上发生的反应是解本题关键,会结合电解质溶液酸碱性书写电极反应式,知道放电时和充电时电极反应式关系,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列粒子半径最小的是( )
| A. | Na+ | B. | Mg2+ | C. | S2- | D. | Cl- |
10.下列叙述不正确的是( )
| A. | 检验Fe2(SO4)3溶液中是否含有FeSO4的实验操作是:取少量待测液于试管中,滴加1-2滴酸性KMnO4溶液 | |
| B. | 碱金属与卤素所形成的化合物具有熔点较高,能溶于水,水溶液能导电,熔融状态下能导电的性质 | |
| C. | 配制FeCl2溶液的实验操作是:在装有适量固体的大试管中加入适量的蒸馏水,再滴加少量稀盐酸并搅拌,同时加入少量的铁粉 | |
| D. | 向紫色石蕊试液中加入过量的过氧化钠粉末振荡,可观察到溶液中有气泡产生,溶液最终变为无色 |
7.某温度下,已知醋酸的电离常数Ka=1.8×10-5,醋酸银的溶度积常数Ksp=1.6×10-3,碳酸银的溶度积常数Ksp=8.3×10-12,在不考虑盐类水解的情况下,下列有关说法正确的是( )
| A. | 该温度下醋酸银的溶解度约为0.668g | |
| B. | 该温度下饱和醋酸水溶液的pH=2.5-$\frac{1}{2}$lg1.8 | |
| C. | 某溶液中含有CH3COO-和CO32-,浓度均为0.01mol/L,向其中逐滴加入0.01 mol/L的AgNO3溶液,CH3COO-离子先产生沉淀 | |
| D. | 醋酸溶液加水稀释后,溶液中导电粒子的数目减少 |
14.下列图象表达正确的是( )
| A. |  如图:可以表示CO2的比例模型 | |
| B. | 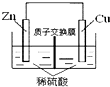 如图表示的锌铜原电池,电池工作一段时间后,右侧溶液的pH不变 | |
| C. | 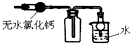 如图:可用于收集干燥氨气 | |
| D. | 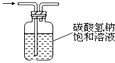 如图:可用于除去氯气中的HCl气体 |
4.日常生活离不开洗涤剂.下列有关洗涤剂的使用不正确的是( )
| A. | 用纯碱溶液清洗餐具上油污 | B. | 用稀硫酸清洗水壶里水垢 | ||
| C. | 用漂白液洗涤白衬衣上红色墨迹 | D. | 用汽油清洗皮肤上的油漆 |
11.有X、Y、Z、W、Q五种短周期元素,原子序数依次增大,其中X与W同主族,其阴离子与He原子电子层结构相同,Z原子的最外层电子数是次外层电子数的3倍,Y元素是植物最重要的营养元素之一,Q元素的一种氧化物是形成酸雨的主要物质之一.下列有关这五种元素的说法不正确的是( )
| A. | X、Y、Z三种元素既可形成只含共价键的化合物,又可形成既含共价键又含离子键的化合物 | |
| B. | Z、W、Q三种元素所形成的简单离子的半径由大到小的顺序是W>Q>Z | |
| C. | Y的简单氢化物通入Q的氧化物的水化物水溶液中可能生成两种盐 | |
| D. | X与W组成的化合物可与水发生氧化还原反应 |




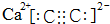 .
.