题目内容
6.地壳中最常见的矿物就是长石,根据古有的元素分为钠长石、钙长石、钾长石等.某工厂为了对钾长石进行充分利用,设计了如下工艺流程: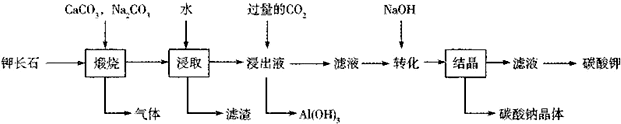
(1)钾长石的成分可视为含有质量分数为64.7%的“SiO2”,含有质量分数为l8.4%的“Al2O3”,含有质量分数为16.9%的“K2O”,该钾长石的化学式为Al2O3•K2O•6SiO2.
(2)上述流程中浸出液中无(填“有”或“无”)Na2SiO3,理由是浸出液中通入过量的二氧化碳气体,只生成氢氧化铝,无硅酸盐生成.
(3)为了提高“浸取”速率,宜采用的措施有将团体粉碎成更小的颗粒、加热、搅拌等(写出一条即可).
(4)写出向浸出液通入过量CO2析出氢氧化铝的离子方程式:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
(5)设计实验检验碳酸钠晶体中是否含有碳酸钾:做焰色反应,若透过蓝色钴玻璃观察到火焰呈紫色,则证明样品中含有碳酸钾,否则不含有碳酸钾.
(6)为了测定Na2CO3•10H2O晶体纯度,取一定质量样品溶于蒸馏水中,加入过量的CaCl2溶液,过滤、洗涤、干燥、称重.如果操作方法都正确,测得样品纯度偏高,可能的原因是Na2CO3•10H2O晶体中部分结晶水失去.
分析 钾长石的成分可视为含有质量分数为64.7%的“SiO2”,含有质量分数为l8.4%的“Al2O3”,含有质量分数为16.9%的“K2O”,则SiO2、Al2O3、K2O的物质的量之比为6:1:1,所以钾长石的化学式为Al2O3•K2O•6SiO2,SiO2中加入碳酸钙、碳酸钠煅烧,再水浸,过滤后可得滤渣为CaSiO3,滤液为偏铝酸钾溶液,通入过量二氧化碳气体,得氢氧化铝沉淀,过滤得碳氢酸钾溶液,再加入氢氧化钠得碳酸钠和碳酸钾,据此答题.
解答 解:钾长石的成分可视为含有质量分数为64.7%的“SiO2”,含有质量分数为l8.4%的“Al2O3”,含有质量分数为16.9%的“K2O”,则SiO2、Al2O3、K2O的物质的量之比为6:1:1,所以钾长石的化学式为Al2O3•K2O•6SiO2,SiO2中加入碳酸钙、碳酸钠煅烧,再水浸,过滤后可得滤渣为CaSiO3,滤液为偏铝酸钾溶液,通入过量二氧化碳气体,得氢氧化铝沉淀,过滤得碳氢酸钾溶液,再加入氢氧化钠得碳酸钠和碳酸钾,
(1)根据上面的分析可知,钾长石的化学式为Al2O3•K2O•6SiO2,
故答案为:Al2O3•K2O•6SiO2;
(2)根据上述流程可知,浸出液中通入过量的二氧化碳气体,只生成氢氧化铝,无硅酸盐生成,所以上述流程中浸出液中无Na2SiO3,
故答案为:无;浸出液中通入过量的二氧化碳气体,只生成氢氧化铝,无硅酸盐生成;
(3)根据影响反应速率的因素可知,为了提高“浸取”速率,宜采用的措施有将团体粉碎成更小的颗粒、加热、搅拌等,
故答案为:将团体粉碎成更小的颗粒、加热、搅拌等;
(4)向浸出液通入过量CO2析出氢氧化铝的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(5)通过做焰色反应,若透过蓝色钴玻璃观察到火焰呈紫色,则证明样品中含有碳酸钾,否则不含有碳酸钾,
故答案为:做焰色反应,若透过蓝色钴玻璃观察到火焰呈紫色,则证明样品中含有碳酸钾,否则不含有碳酸钾;
(6)当Na2CO3•10H2O晶体中部分结晶水失去时,会导致样品中碳酸钠的含量偏高,则测得的样品纯度会偏高,
故答案为:Na2CO3•10H2O晶体中部分结晶水失去.
点评 本题以钾长石的加工为载体,考查混合物的分离和提纯,侧重考查实验基本操作、元素化合物性质,明确流程图中各个步骤发生的反应及物质分离方法是解本题关键,题目难度不大.

 初中暑期衔接系列答案
初中暑期衔接系列答案| A. | 钢铁发生电化学腐蚀时,负极反应为Fe-3e-=Fe3+ | |
| B. | 镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁制品中铁的腐蚀速率更快 | |
| C. | 在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳极电化学保护法 | |
| D. | 不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬 |
| A. | 六方最密堆积和面心立方最密堆积的原子堆积方式,空间利用率最高 | |
| B. | 分子晶体中,分子间作用力越大,分子越稳定 | |
| C. | 熔点:BaO>CaO>NaCl>KCl | |
| D. |  某晶体的晶胞如图所示,这种晶体中A、B、C三种粒子个数之比是1:2:1 |
| A. |  如图:可以表示CO2的比例模型 | |
| B. | 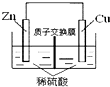 如图表示的锌铜原电池,电池工作一段时间后,右侧溶液的pH不变 | |
| C. | 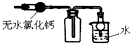 如图:可用于收集干燥氨气 | |
| D. | 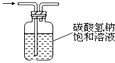 如图:可用于除去氯气中的HCl气体 |
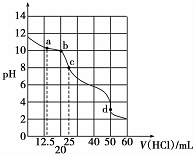 在常温下,0.1000mol•L-1Na2CO3溶液25mL用0.1000mol•L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.1000mol•L-1Na2CO3溶液25mL用0.1000mol•L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO3-)>c(OH-) | B. | b点:5c(Cl-)>4c( HCO3-)+4c(CO32-) | ||
| C. | c点:c( OH -)=c(H+)+c(HCO3-)+2c(H2CO3) | D. | d点:c(H+)=c(CO32-)+c( HCO3-)+c(OH -) |
| A. | X、Y、Z三种元素既可形成只含共价键的化合物,又可形成既含共价键又含离子键的化合物 | |
| B. | Z、W、Q三种元素所形成的简单离子的半径由大到小的顺序是W>Q>Z | |
| C. | Y的简单氢化物通入Q的氧化物的水化物水溶液中可能生成两种盐 | |
| D. | X与W组成的化合物可与水发生氧化还原反应 |
| A. | 60gHCHO和CH3COOH的混合物中存在的π键与σ键的数目总数为8NA | |
| B. | 2L0.5mol•L-1CH3COOD(D为重氢原子)溶液中,CH3COOD和DHO的微粒数之和为NA | |
| C. | 28g核素${\;}_{7}^{14}$N发生下列变化:${\;}_{7}^{14}$+${\;}_{0}^{1}$n→${\;}_{6}^{14}$+${\;}_{1}^{1}$H,通过该化学反应能生成2NA个${\;}_{1}^{1}$H | |
| D. | 450℃时,在催化剂作用下,将2molSO2与一定量的O2混合一段时间后测得SO2消耗$\frac{1}{2}$,则该正反应消耗了NA个SO2分子. |
| A. | 3种 | B. | 4种 | C. | 6种 | D. | 8种 |
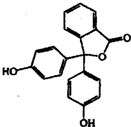 苯酚与邻苯二甲酸酐(
苯酚与邻苯二甲酸酐(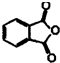 )在一定条件下反应可制得酚酞,酚酞的分子结构如图所示,下列说法正确的是( )
)在一定条件下反应可制得酚酞,酚酞的分子结构如图所示,下列说法正确的是( )| A. | 上述制酚酞的反应属于取代反应 | |
| B. | 酚酞分子中的碳原子有可能共处于同一平面 | |
| C. | 若与NaOH溶液反应.1mol酚酞最多可消耗4 molNaOH | |
| D. | 将酚酞溶于酒精配成的酚酞试剂.滴入中性或酸性水溶液中可能会出现白色浑浊 |