题目内容
设nA为阿佛加德罗常数的值,下列说法正确的是( )
| A、常温下,23gNO2含有nA个氧原子 |
| B、1molFe与足量的稀HNO3反应转移2nA个电子 |
| C、常温常压下,22.4LCCl4含有nA个CCl4分子 |
| D、1molFe2+与 足量H2O2溶液反应,转移2nA个电子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、NO2在容器中存在平衡N2O4?2NO2,根据二氧化氮与四氧化二氮的最简式NO2进行计算;
B、铁与硝酸反应产物可能为铁离子或亚铁离子,1mol铁完全反应失去的电子的物质的量可能为2mol或者3mol;
C、不是标准状况下,且四氯化碳不是气体,不能使用标况下的气体摩尔体积计算四氯化碳的物质的量;
D、亚铁离子被氧化成铁离子,1mol亚铁离子失去1mol电子.
B、铁与硝酸反应产物可能为铁离子或亚铁离子,1mol铁完全反应失去的电子的物质的量可能为2mol或者3mol;
C、不是标准状况下,且四氯化碳不是气体,不能使用标况下的气体摩尔体积计算四氯化碳的物质的量;
D、亚铁离子被氧化成铁离子,1mol亚铁离子失去1mol电子.
解答:
解:A、23g二氧化氮中含有最简式NO20.5mol,含有1mol氧原子,含有nA个氧原子,故A正确;
B、1mol铁与足量硝酸完全反应生成了铁离子,失去的电子的物质的量为3mol,反应转移3nA个电子,故B错误;
C、不是标况下,四氯化碳标况下也不是气体,题中条件无法计算四氯化碳的物质的量,故C错误;
D、1mol亚铁离子完全被氧化成铁离子失去1mol电子,转移nA个电子,故D错误;
故选A.
B、1mol铁与足量硝酸完全反应生成了铁离子,失去的电子的物质的量为3mol,反应转移3nA个电子,故B错误;
C、不是标况下,四氯化碳标况下也不是气体,题中条件无法计算四氯化碳的物质的量,故C错误;
D、1mol亚铁离子完全被氧化成铁离子失去1mol电子,转移nA个电子,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数,题目难度不大,注意明确标准状况物质的状态、标况下气体摩尔体积的使用条件,熟练掌握阿伏伽德罗常数与物质的量、摩尔质量之间的转化关系.

练习册系列答案
相关题目
某研究性学习小组讨论下列四种装置的有关用法,其中不合理的是( )
A、 此装置:可用来证明碳的非金属性比硅强 |
B、 此装置:橡皮管的作用是平衡压强,使水顺利流下 |
C、 此装置:用图示的方法能检查此装置的气密性 |
D、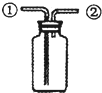 此装置:可收集二氧化碳或氨气 |
某温度、压强下,将一定量反应物通入密闭容器进行反应:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+QkJ/mol(Q>0),下列叙述正确的是( )
| A、反应过程中,若增大压强能提高SiCl4的转化率 |
| B、若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C、若单位时间内生成x molHCl的同时,生成x molH2,则反应达到平衡状态 |
| D、使用过量的H2或升高温度都可以提高SiCl4的转化率 |
下列四个反应中,在反应类型上与其他三个不同的是( )
| A、C与CuO |
| B、Zn与HCl |
| C、H2与CuO |
| D、HCl与CuO |
 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+ 比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.请回答下列问题: