题目内容
钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
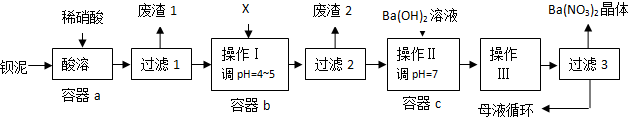
已知:①Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小
③KSP(BaSO4)=1.1×10-10,KSP (BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤.用离子方程式说明提纯原理:
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为:
(3)该厂结合本厂实际,选用的X为 ;
A.BaCl2 B.BaCO3 C.Ba(NO3)2 D.Ba(OH)2
(4)废渣2为
(5)操作Ⅲ为
(6)过滤3后的母液应循环到容器 中.(填“a”、“b”或“c”)
(7)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,则该Ba(NO3)2的纯度为 (相对分子质量:Ba(NO3)2为261,BaSO4为233)

已知:①Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小
③KSP(BaSO4)=1.1×10-10,KSP (BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤.用离子方程式说明提纯原理:
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为:
(3)该厂结合本厂实际,选用的X为
A.BaCl2 B.BaCO3 C.Ba(NO3)2 D.Ba(OH)2
(4)废渣2为
(5)操作Ⅲ为
(6)过滤3后的母液应循环到容器
(7)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,则该Ba(NO3)2的纯度为
考点:难溶电解质的溶解平衡及沉淀转化的本质,制备实验方案的设计
专题:电离平衡与溶液的pH专题
分析:(1)根据沉淀溶解平衡的移动分析;
(2)Ba(FeO2)2与中钡元素和铁元素的化合价分析反应产物,然后写出方程式;
(3)X既要能中和硝酸,又不产生新杂质,结合本厂实际,故可用BaCO3;
(4)根据三价铁离子和二价铁离子完全沉淀时的PH分析;
(5)根据从溶液中提取溶质的方法分析;
(6)根据母液中的成分判断;
(7)根据沉淀硫酸钡的质量,结合方程式计算求出硝酸钡的质量,再求样品的纯度.
(2)Ba(FeO2)2与中钡元素和铁元素的化合价分析反应产物,然后写出方程式;
(3)X既要能中和硝酸,又不产生新杂质,结合本厂实际,故可用BaCO3;
(4)根据三价铁离子和二价铁离子完全沉淀时的PH分析;
(5)根据从溶液中提取溶质的方法分析;
(6)根据母液中的成分判断;
(7)根据沉淀硫酸钡的质量,结合方程式计算求出硝酸钡的质量,再求样品的纯度.
解答:
解:(1)将BaCO3加入足量的饱和Na2CO3溶液中,存在BaSO4(s)?Ba2+(aq)+SO42-(aq),钡离子与碳酸根离子结合生成碳酸钡沉淀,使硫酸钡的沉淀溶解平衡正移,从而转化为碳酸钡,其反应的离子方程式为:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq),
故答案为:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq);
(2)Ba(FeO2)2与中钡元素为+2价,铁元素为+3价,所以反应产物为Ba(NO3)2和Fe(NO3)3,所以其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X既要能中和硝酸,又不产生新杂质,结合工厂实际,应该用BaCO3来调节pH,故答案为:B;
(4)已知Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7,流程中调节PH为4~5,所以三价铁离子会完全转化为沉淀Fe(OH)3,
故答案为:Fe(OH)3;
(5)从溶液中提取溶质的方法为:蒸发浓缩、冷却结晶,然后过滤,所以操作Ⅲ为蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶;
(6)通过蒸发浓缩、冷却结晶、过滤,得到硝酸钡晶体,剩余的滤液中仍含有少量的Ba(NO3)2,所以含有Ba(NO3)2的母液应该,循环到容器c中,
故答案为:c;
(7)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为:Ba(NO3)2+H2SO4=BaSO4+2HNO3,
设参加反应的Ba(NO3)2为xg,
Ba(NO3)2+H2SO4=BaSO4+2HNO3
261 233
x mg
则
=
,解得x=
,所以该Ba(NO3)2的纯度为
×100%=
×100%,
故答案为:
×100%.
故答案为:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq);
(2)Ba(FeO2)2与中钡元素为+2价,铁元素为+3价,所以反应产物为Ba(NO3)2和Fe(NO3)3,所以其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X既要能中和硝酸,又不产生新杂质,结合工厂实际,应该用BaCO3来调节pH,故答案为:B;
(4)已知Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7,流程中调节PH为4~5,所以三价铁离子会完全转化为沉淀Fe(OH)3,
故答案为:Fe(OH)3;
(5)从溶液中提取溶质的方法为:蒸发浓缩、冷却结晶,然后过滤,所以操作Ⅲ为蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶;
(6)通过蒸发浓缩、冷却结晶、过滤,得到硝酸钡晶体,剩余的滤液中仍含有少量的Ba(NO3)2,所以含有Ba(NO3)2的母液应该,循环到容器c中,
故答案为:c;
(7)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为:Ba(NO3)2+H2SO4=BaSO4+2HNO3,
设参加反应的Ba(NO3)2为xg,
Ba(NO3)2+H2SO4=BaSO4+2HNO3
261 233
x mg
则
| 261 |
| x |
| 233 |
| mg |
| 261m |
| 233 |
| 261m | ||
|
| 261m |
| 233w |
故答案为:
| 261m |
| 233w |
点评:本题考查学生在“工艺流程阅读、相关反应化学方程式书写、化学反应条件控制的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,考查学生对新信息的处理能力,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在实验室中,对下列事故或药品的处理正确的是( )
| A、有大量的氯气泄漏时,用氢氧化钠溶液浸湿软布蒙面,并迅速离开现场 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、保存FeSO4溶液时,常加入少量铁屑 |
| D、少量的金属钠可以保存在CCl4中 |
设nA为阿佛加德罗常数的值,下列说法正确的是( )
| A、常温下,23gNO2含有nA个氧原子 |
| B、1molFe与足量的稀HNO3反应转移2nA个电子 |
| C、常温常压下,22.4LCCl4含有nA个CCl4分子 |
| D、1molFe2+与 足量H2O2溶液反应,转移2nA个电子 |
以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是( )

| A、化合 置换 分解 复分解 |
| B、置换 复分解 化合 分解 |
| C、置换 化合 复分解 分解 |
| D、置换 化合 分解 复分解 |
 氨是最重要的氮肥,是产量最大的化工产品之一.
氨是最重要的氮肥,是产量最大的化工产品之一.