题目内容
下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
| A、Na+、Ba2+、Cl-、SO42- |
| B、Ca2+、HCO3-、C1-、K+ |
| C、Fe3+、K+、I-、H+ |
| D、H+、Cl-、Na+、CO32- |
考点:离子共存问题
专题:离子反应专题
分析:具有还原性的离子与具有氧化性的离子,发生氧化还原反应而不能大量共存,以此解答该题.
解答:
解:A.Ba2+、SO42-结合生成沉淀,发生复分解反应不能共存,不是氧化还原反应,故A不选;
B.该组离子之间不反应,能大量共存,故B不选;
C.因Fe3+、I-、H+发生氧化还原反应,不能大量共存,故C选;
D.H+、CO32-结合生成水和二氧化碳,发生复分解反应不能共存,故D不选;
故选C.
B.该组离子之间不反应,能大量共存,故B不选;
C.因Fe3+、I-、H+发生氧化还原反应,不能大量共存,故C选;
D.H+、CO32-结合生成水和二氧化碳,发生复分解反应不能共存,故D不选;
故选C.
点评:本题考查离子的共存,为高考常见题型,侧重氧化还原反应的考查,把握离子的氧化性、还原性为解答的关键,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列事实与胶体性质无关的是( )
| A、明矾可用来净水 |
| B、一束平行光线照射蛋白质溶液时,从一侧可以看到光亮的通路 |
| C、FeCl3溶液中滴入NaOH溶液,出现红褐色沉淀 |
| D、Al(OH)3或Fe(OH)3胶体可以吸附水中的悬浮颗粒而沉降 |
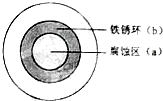 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )| A、液滴中的Cl - 由a区向b区迁移 |
| B、铁腐蚀严重的区域,生锈也严重 |
| C、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH- 形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D、液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH- |
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | ||
| B、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | ||
C、CH3COOH 溶液加水稀释后,溶液中
| ||
| D、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
下列说法正确的是( )
A、CH4(g)+
| ||
| B、在25℃、101kPa,1mol硫和2mol硫的燃烧热相等 | ||
| C、CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 | ||
| D、101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
下列实验能达到实验目的是( )
| A、在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 |
| B、可用四氯化碳萃取出碘水中的碘,但不能用酒精 |
| C、用玻璃棒搅拌漏斗中的液体以加快过滤速度 |
| D、加入盐酸以除去硫酸钠中的少量碳酸钠杂质 |
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.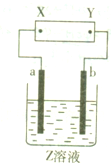 如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出.符合这一情况的是附表中的( )
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出.符合这一情况的是附表中的( )