题目内容
1.市场上销售的某种食盐精制盐的配料是食盐,碘酸钾,抗结剂,碘含量(以碘计)是20-50mg/kg,已知:I2+2S2O32-═2I-+S4O62-,其学生测定使用精制盐的碘含量,其步骤:a.准确称取Wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2×10-3mol•L-1的Na2S2O3溶液10.00mL,恰好反应完全.
(1)判断c中恰好反应完全的依据是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
(2)b中反应所产生的I2的物质的量是1.0×10-5mol.
(3)根据以上实验,所测精制盐的碘含量是$\frac{423}{w}$mg/kg(用含W的代数式表示)
分析 (1)溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色;
(2)根据反应方程式I2+2S2O32-═2I-+S4O62-计算;
(3)根据I原子守恒找出碘酸钾中碘原子与碘单质的关系式分析计算.
解答 解:(1)碘遇淀粉变蓝色,所以溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色,说明反应到终点,判断c中反应恰好完全所依据的现象是:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色,
故答案为:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;
(2)b中生成的碘在c中反应I2+2S2O32-═2I-+S4O62-,所以
I2 ~~~~~~2S2O32-,
1mol 2mol
1.0×10-5mol 2.0×10-3mol•L-1×0.01L=2.0×10-5mol,
故答案为:1.0×10-5;
(3)根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O可知
I~~~~~KIO3~~~~~3I2
碘酸钾中的碘 127g 3mol
m 1.0×10-5mol
所以m=$\frac{127}{3}$×10-5g,
所以设每千克食盐中含碘$\frac{1000g}{wg}$×$\frac{127}{3}$×10-5g=$\frac{0.423}{w}$g=$\frac{423}{w}$mg,即为$\frac{423}{w}$mg/kg,
故答案为:$\frac{423}{w}$.
点评 本题考查了氧化还原反应方程式的配平及有关计算,计算时注意是求食盐中碘的含量不是碘酸钾的含量.

| A. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se是同一种核素 | |
| B. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素 | |
| C. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se分别含有44和46个质子 | |
| D. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se都含有34个中子 |
| A. | Na+ | B. | P | C. | Cl | D. | F- |
| A. | 只有氢氧化钠 | B. | 碳酸钠和氢氧化钠 | ||
| C. | 碳酸氢钠和氢氧化钠 | D. | 只有碳酸钠 |
| A. | 向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl) 减小 | |
| B. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| C. | 若向0.0008 mol•L-1的K2CrO4溶液中加入等体积0.002 mol•L-1的AgNO3溶液,则CrO42-完全沉淀(提示:沉淀完全c(CrO42-)≤10-5 mol•L-1) | |
| D. | 若将0.001 mol•L-1 AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
| A. | 溶液中离子数目增加,导电性增强 | |
| B. | 加水促进醋酸电离,但[H+]、[OH-]均减小 | |
| C. | 加水稀释到1000 mL,溶液的pH=5 | |
| D. | $\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH]}$增大 |
| A. | H2S的电子式: | B. | S2-的结构示意图: | ||
| C. | Na2O2的电子式: | D. | CCl4的电子式: |
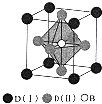 A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:
A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题: NH3•H2O+H+(用离子方程式表示);
NH3•H2O+H+(用离子方程式表示); Ca2+(aq)+CuA(s).
Ca2+(aq)+CuA(s).