题目内容
6.工业上采用接触法制硫酸,其中在接触室进行的反应是( )| A. | S+O2 $\frac{\underline{\;\;△\;\;}}{\;}$ SO2 | B. | 4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2 | ||
| C. | 2SO2+O2 $?_{加热}^{催化剂}$ 2SO3 | D. | SO3+H2O=H2SO4 |
分析 工业接触法制硫酸时,在沸腾炉中制取二氧化硫,在接触室中制备三氧化硫,在吸收塔中制取硫酸,据此分析解答.
解答 解:A.工业接触法制硫酸时,硫铁矿在沸腾炉灼烧来制取二氧化硫气体,原料不是硫磺,故A错误;
B.工业接触法制硫酸时,硫铁矿在沸腾炉灼烧来制取二氧化硫气体,故B错误;
C.二氧化硫和氧气在接触室中发生催化氧化来制备三氧化硫,故C正确;
D.三氧化硫在吸收塔中被98%的浓硫酸吸收制取发烟硫酸,故D错误;
故选C.
点评 本题考查工业制取硫酸使用的设备,明确制备过程发生的反应及使用设备即可解答,题目难度不大.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
19.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是几种短周期元素的原子半径及主要化合价:
(1)用元素符号标出A、C、D、F在元素周期表中的相应位置(以下为元素周期表的一部分).
(2)A元素处于周期表中三周期IIA族.
(3)写出D离子的结构示意图 .
.
(4)上述A~F六种元素最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(5)C元素气态氢化物的电子式为 .它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.
.它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.
(6)B的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(7)元素E与元素F对比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是CD(填选项字母).
A.气态氢化物水溶液的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.气态氢化物的稳定性.
| 元素(或元 素代码) | 铍 | A | B | C | D | E | F |
| 原子半径 (10-10m) | 0.89 | 1.60 | 1.43 | 0.75 | 0.74 | 1.02 | 0.99 |
| 最高价态 | +2 | +2 | +3 | +5 | - | +6 | +7 |
| 最低价态 | - | - | - | -3 | -2 | -2 | -1 |
(2)A元素处于周期表中三周期IIA族.
(3)写出D离子的结构示意图
 .
.(4)上述A~F六种元素最高价氧化物对应水化物中酸性最强的是HClO4(填化学式).
(5)C元素气态氢化物的电子式为
 .它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.
.它与C元素最高价氧化物水化物反应的生成物是属于离子(离子或共价)化合物,其中含有的化学键类型有离子键、共价键.(6)B的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为Al(OH)3+3H+=Al3++3H2O.
(7)元素E与元素F对比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是CD(填选项字母).
A.气态氢化物水溶液的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.气态氢化物的稳定性.
17.根据下列实验的操作和现象,可以得出正确结论的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向滴加有KSCN的FeCl2溶液,不断滴加氯水 | 溶液颜色先变红后褪色 | Fe2+先是被氧化为Fe3+,后来又被还原为Fe2+ |
| B | 向浓盐酸中加入少量碳酸钠溶液,将产生的气体通入苯酚钠溶液 | 苯酚钠溶液中出现白色浑浊 | 实验有缺陷,不能证明酸性:盐酸>碳酸>苯酚 |
| C | 在酸性KMnO4溶液中通入SO2 | 溶液褪色 | SO2具有漂白性 |
| D | 用标准浓度的烧碱溶液滴定未知浓度的盐酸,酚酞做指示剂 | 锥形瓶内溶液颜色由无色变为浅红色立即停止滴定 | 酸碱恰好中和 |
| A. | A | B. | B | C. | C | D. | D |
1.下列说法正确的是( )
| A. | 合成硫酸的工业尾气可以直接排入大气 | |
| B. | 进入接触室的气体,必须先经净化、干燥 | |
| C. | 从沸腾炉中排出的炉渣可以作为肥料 | |
| D. | 在高温、高压下由SO2和O2合成SO3 |
18.下列实验装置能达到实验目的是( )
| A | B | C | D | |
| 实验装置 |  | 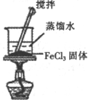 | 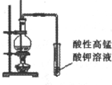 |  |
| 实验目的 | 比较非金属性强弱S>C>Si | 制取少量的Fe(OH)3胶体 | 证明乙醇与浓H2SO4共热生成了乙烯 | 比较不同催化剂的催化效果 |
| A. | A | B. | B | C. | C | D. | D |
15.某中性有机物(分子式为C10H20O2)在稀硫酸作用下加热得到M和N两种有机物,且M被酸性KMnO4溶液作用可直接得到N.下列说法正确的是( )
| A. | M的分子式为C5H10O | |
| B. | 该中性有机物有4种(不考虑立体异构) | |
| C. | 上述过程发生的所有反应与油脂化反应的反应类型相同 | |
| D. | M和N都可以发生取代反应、都能与Na反应生成H2,因此具有相同官能团 |
16.工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法.下列关于工业上制硫酸与硝酸的说法中不正确的是( )
| A. | 在沸腾炉中进行的反应为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 | |
| B. | 制硫酸在吸收塔中是用水来吸收SO3 | |
| C. | 氨催化氧化制硝酸过程中的三个主要反应都属于氧化还原反应 | |
| D. | 硫酸工业、硝酸工业都需要对工业尾气进行处理 |
