题目内容
18.下列实验装置能达到实验目的是( )| A | B | C | D | |
| 实验装置 |  | 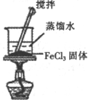 | 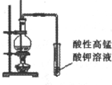 |  |
| 实验目的 | 比较非金属性强弱S>C>Si | 制取少量的Fe(OH)3胶体 | 证明乙醇与浓H2SO4共热生成了乙烯 | 比较不同催化剂的催化效果 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.比较非金属性,可根据元素对应的最高价氧化物的水化物的酸性强弱比较;
B.饱和氯化铁溶液在沸水中水解制备胶体;
C.乙醇能使酸性高锰酸钾褪色;
D.应该使用相同质量分数的过氧化氢溶液.
解答 解:A.比较非金属性,可根据元素对应的最高价氧化物的水化物的酸性强弱比较,硫酸与碳酸钠反应生成二氧化碳,二氧化碳气体通入硅酸钠溶液中可得硅酸沉淀,可证明非金属性的强弱,故A正确;
B.饱和氯化铁溶液在沸水中水解制备胶体,图中为固体的溶解操作,不能制备胶体,故B错误;
C.乙醇能使酸性高锰酸钾褪色,应除掉乙醇后再通入酸性高锰酸钾溶液,故C错误;
D.比较不同催化剂的催化效果,应该使用相同质量分数的过氧化氢溶液,故D错误.
故选A.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
11.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 NaOH H2 |
12.0.9molFe2O3与一定量CO反应后得到固体X,将X溶于足量稀盐酸,再通入0.5molCl2,恰好氧化完全.则X的组成及物质的量之比可能是( )
| A. | 2:3混合的Fe3O4与FeO | B. | 3:5:4混合的Fe3O4、FeO与Fe | ||
| C. | 4:5混合的Fe2O3和FeO | D. | 1:1:4混合的Fe2O3、Fe3O4与FeO |
6.工业上采用接触法制硫酸,其中在接触室进行的反应是( )
| A. | S+O2 $\frac{\underline{\;\;△\;\;}}{\;}$ SO2 | B. | 4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2 | ||
| C. | 2SO2+O2 $?_{加热}^{催化剂}$ 2SO3 | D. | SO3+H2O=H2SO4 |
7.下列有关方程式描述中,反应类型与其它三个反应不同的是( )
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 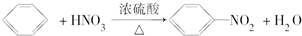 | |
| C. | CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3COOC2H5+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
8.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料.下列叙述不正确的是( )
| A. | 原子最外层电子数:Y>X>W>Z | B. | 原子半径:Z>W>X>Y | ||
| C. | 电负性:Y>X>W>Z | D. | 简单气态氢化物的沸点:Y>X |
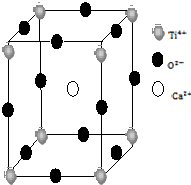 金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.
金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”. ).
).
 ;
;
 .
. 与O2反应的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
与O2反应的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O. .
. .
.
 生成中间体N,N与
生成中间体N,N与 合成工程塑料M(
合成工程塑料M( ),则由N合成M的聚合反应方程式为n
),则由N合成M的聚合反应方程式为n +n
+n