题目内容
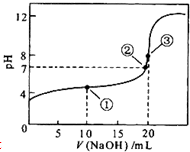 常温下,用0.1mol?L-1 NaOH溶液滴定20mL 0.1mol?L-1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol?L-1 NaOH溶液滴定20mL 0.1mol?L-1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( )| A、点①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | ||
| B、点②所示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH)+c(OH-) | ||
| C、点③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | ||
D、在整个滴定过程中:溶液中
|
考点:离子浓度大小的比较
专题:
分析:A.点①所示溶液中,溶质为等浓度的醋酸钠和醋酸,醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),结合物料守恒可得c(CH3COO-)>c(Na+)>c(CH3COOH);
B.根据混合液中的电荷守恒判断;
C.点③所示溶液中的溶质为醋酸钠,醋酸根离子部分水解,溶液显示碱性,则:c(CH3COO-)<c(Na+)、c(OH-)>c(H+);
D.
为醋酸电离平衡常数的倒数,滴定过程中醋酸的电离平衡常数不变.
B.根据混合液中的电荷守恒判断;
C.点③所示溶液中的溶质为醋酸钠,醋酸根离子部分水解,溶液显示碱性,则:c(CH3COO-)<c(Na+)、c(OH-)>c(H+);
D.
| c(CH3COOH) |
| c(C3HCOO-)?c(H+) |
解答:
解:A.点①所示溶液中,滴入10mL氢氧化钠溶液,则反应后溶液中溶质为等浓度的醋酸钠和醋酸,由于醋酸的电离程度大于醋酸根离子的水解程度,溶液显示酸性,则:c(H+)>c(OH-)、c(CH3COO-)>c(CH3COOH),结合物料守恒可得:c(CH3COO-)>c(Na+)>c(CH3COOH),故A错误;
B.点②所示溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)+c(H+)<c(CH3COO-)+c(CH3COOH)+c(OH-),故B错误;
C.点③所示溶液中,氢氧化钠与醋酸恰好反应生成醋酸钠,醋酸根离子部分水解,溶液显示碱性,则:c(CH3COO-)<c(Na+)、c(OH-)>c(H+),溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.
为醋酸电离平衡常数的倒数,由于滴定过程中醋酸的电离平衡常数始终不变,则
的值不变,故D正确;
故选D.
B.点②所示溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)+c(H+)<c(CH3COO-)+c(CH3COOH)+c(OH-),故B错误;
C.点③所示溶液中,氢氧化钠与醋酸恰好反应生成醋酸钠,醋酸根离子部分水解,溶液显示碱性,则:c(CH3COO-)<c(Na+)、c(OH-)>c(H+),溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.
| c(CH3COOH) |
| c(C3HCOO-)?c(H+) |
| c(CH3COOH) |
| c(C3HCOO-)?c(H+) |
故选D.
点评:本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,明确反应后溶液中的溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
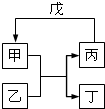 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图5所示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图5所示转化关系的是( )| 甲 | 乙 | 丙 | 戊 | |
| ① | NH3 | O2 | NO2 | H2 |
| ② | Fe | H2O | Fe3O4 | Al |
| ③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A、①③ | B、②③ | C、②④ | D、①④ |
下列实验能成功的是( )
| A、将乙酸和乙醇混合加热制乙酸乙酯 |
| B、苯和浓溴水反应制溴苯 |
| C、CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
| D、用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀 |
已知25℃时三种金属硫化物的溶度积常数分别是:KSP(FeS)=6.3×10-18 mol2?L-2、KSP(CuS)=1.3×10-36 mol2?L-2、KSP(MnS)=2.5×10-13mol2?L-2,下列说法中正确的是( )
| A、25℃时,FeS的溶解度大于MnS的溶解度 |
| B、25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol?L-1 |
| C、除去某溶液中的Cu2+,可以选用FeS或MnS作沉淀剂 |
| D、因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
现有Na2CO3、H2SO4、BaCl2三种物质的量浓度与体积都相等的溶液,若将它们都混合起来,并充分反应后过滤,则最后所得滤液中含有的离子有( )
| A、Na+和Cl- |
| B、H+和CO32- |
| C、H+和Cl- |
| D、Na+和SO42- |
常温时,下列各组离子在指定溶液中,能大量共存的是( )
| A、pH=11的溶液中:Na+、[Al(OH)4]-、S2-、SO32- |
| B、水电离的浓度为 10-12mol?L-1的溶液中:Cl-、CO32-、NH4+、SO32- |
| C、使石蕊变红的溶液中:Fe2+、MnO4-、Na+、SO42- |
| D、中性溶液中:Fe3+、Al3+、I-、S2- |
 已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如下图所示(某些条件巳略去).请回答:
已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如下图所示(某些条件巳略去).请回答: