题目内容
常温时,下列各组离子在指定溶液中,能大量共存的是( )
| A、pH=11的溶液中:Na+、[Al(OH)4]-、S2-、SO32- |
| B、水电离的浓度为 10-12mol?L-1的溶液中:Cl-、CO32-、NH4+、SO32- |
| C、使石蕊变红的溶液中:Fe2+、MnO4-、Na+、SO42- |
| D、中性溶液中:Fe3+、Al3+、I-、S2- |
考点:离子共存问题
专题:
分析:A.pH=11的溶液为碱性溶液,溶液中存在大量氢氧根离子,Na+、[Al(OH)4]-、S2-、SO32-之间不发生反应,都不与氢氧根离子反应;
B.水电离的浓度为 10-12mol?L-1的溶液中存在大量氢离子或氢氧根离子,碳酸根离子、亚硫酸根离子与氢离子反应,铵根离子与氢氧根离子反应;
C.使石蕊变红的溶液中存在大量氢离子,高锰酸根离子能够氧化亚铁离子;
D.铁离子能够氧化硫离子、碘离子,铝离子能够与硫离子发生双水解反应.
B.水电离的浓度为 10-12mol?L-1的溶液中存在大量氢离子或氢氧根离子,碳酸根离子、亚硫酸根离子与氢离子反应,铵根离子与氢氧根离子反应;
C.使石蕊变红的溶液中存在大量氢离子,高锰酸根离子能够氧化亚铁离子;
D.铁离子能够氧化硫离子、碘离子,铝离子能够与硫离子发生双水解反应.
解答:
解:A.pH=11的溶液中存在大量氢氧根离子,Na+、[Al(OH)4]-、S2-、SO32-之间不发生反应,且都不与氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.水电离的浓度为10-12mol?L-1的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,CO32-、SO32-与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.使石蕊变红的溶液为酸性溶液,酸性MnO4-具有强氧化性,能够氧化Fe2+,在溶液中不能大量共存,故C错误;
D.Fe3+能够氧化I-、S2-,Al3+、S2-之间发生双水解反应,在溶液中不能大量共存,故D错误;
故选A.
B.水电离的浓度为10-12mol?L-1的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,CO32-、SO32-与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.使石蕊变红的溶液为酸性溶液,酸性MnO4-具有强氧化性,能够氧化Fe2+,在溶液中不能大量共存,故C错误;
D.Fe3+能够氧化I-、S2-,Al3+、S2-之间发生双水解反应,在溶液中不能大量共存,故D错误;
故选A.
点评:本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
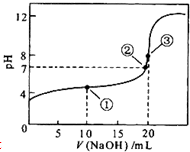 常温下,用0.1mol?L-1 NaOH溶液滴定20mL 0.1mol?L-1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol?L-1 NaOH溶液滴定20mL 0.1mol?L-1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( )| A、点①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | ||
| B、点②所示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH)+c(OH-) | ||
| C、点③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | ||
D、在整个滴定过程中:溶液中
|
芳块类大环化合物是新兴的一种富碳共轭大环状分子.苯乙炔(  )可用合成一系列芳炔类大环化合物,其结构如下,有关叙述正确的是( )
)可用合成一系列芳炔类大环化合物,其结构如下,有关叙述正确的是( )

 )可用合成一系列芳炔类大环化合物,其结构如下,有关叙述正确的是( )
)可用合成一系列芳炔类大环化合物,其结构如下,有关叙述正确的是( )
| A、上述四种物质属于苯乙炔的同系物 |
| B、第一种物质的分子式为C18H12 |
| C、它们可通过苯乙炔的加成反应获得 |
| D、该系列化合物的含碳量均相同 |
化学在生产和日常生活中有着重要的应用.下列说法正确是( )
| A、汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 |
| B、向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO3,可减少对大气的污染 |
| C、高纯度的硅单质广泛用于制作光导纤维 |
| D、大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨 |
下列有关盐酸的说法中正确的是( )
| A、纯净的盐酸是纯净物 |
| B、盐酸就是液态氯化氢 |
| C、盐酸中所有阳离子所带的正电荷数与所有阴离子所带的负电荷数相等 |
| D、浓盐酸有腐蚀性,稀盐酸没有腐蚀性 |
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5,其主要来源是化石燃料的燃烧.下列物质中,不属于化石燃料的是( )
| A、煤 | B、石油 | C、天然气 | D、氢气 |
 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,有关说法正确的是( )| A、电极2发生氧化反应 |
| B、电池工作时,Na+向负极移动 |
| C、电流由电极1经外电路流向电极2 |
| D、电极1发生的电极反应为:2NH3+6OH--6e-=N2↑+6H2O |
今有NH3、O2、NO2在标准状况下的混合气体20.16L,通过稀硫酸后,溶液质量增加了34.1g,气体缩小至2.24L(标况下),将余烬木条插入其中,木条不复燃,则原混合气中NH3、O2、NO2物质的量比为( )
| A、1:1:7 |
| B、2:2:5 |
| C、3:1:4 |
| D、5:2:2 |
将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积可能是( )
| A、1.5mL | B、2.4mL |
| C、3.6mL | D、4mL |