题目内容
现有Na2CO3、H2SO4、BaCl2三种物质的量浓度与体积都相等的溶液,若将它们都混合起来,并充分反应后过滤,则最后所得滤液中含有的离子有( )
| A、Na+和Cl- |
| B、H+和CO32- |
| C、H+和Cl- |
| D、Na+和SO42- |
考点:离子方程式的有关计算
专题:离子反应专题
分析:设浓度均为1mol/L,体积均为1L,则物质的量均为1mol,发生SO42-+Ba2+=BaSO4↓、CO32-+2H+=CO2↑+H2O,溶液中含氯化钠,以此来解答.
解答:
解:设浓度均为1mol/L,体积均为1L,则物质的量均为1mol,则H+、Na+和Cl-均为2mol,CO32-、SO42-、Ba2+均为1mol,发生SO42-+Ba2+=BaSO4↓、CO32-+2H+=CO2↑+H2O,则充分反应后过滤,则最后所得滤液中含有的离子有Na+和Cl-,
故选A.
故选A.
点评:本题考查离子反应的计算,为高频考点,侧重于学生的分析能力的考查,学生应考虑到物质的量对反应的影响及离子反应实质,注意过量的分析,题目难度不大.

练习册系列答案
相关题目
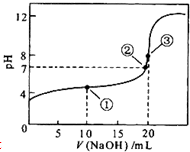 常温下,用0.1mol?L-1 NaOH溶液滴定20mL 0.1mol?L-1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol?L-1 NaOH溶液滴定20mL 0.1mol?L-1CH3COOH溶液的滴定曲线如图所示.下列说法正确的是( )| A、点①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | ||
| B、点②所示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH)+c(OH-) | ||
| C、点③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | ||
D、在整个滴定过程中:溶液中
|
配制0.50mol?L-1的NaOH溶液245ml,下列操作正确的是( )
| A、用托盘天平称取4.9gNaOH固体 |
| B、NaOH固体加蒸馏水溶解,要待溶液冷却到室温后,再转移至容量瓶中 |
| C、容量瓶不能用玻璃瓶塞、应用塑料瓶塞 |
| D、定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
芳块类大环化合物是新兴的一种富碳共轭大环状分子.苯乙炔(  )可用合成一系列芳炔类大环化合物,其结构如下,有关叙述正确的是( )
)可用合成一系列芳炔类大环化合物,其结构如下,有关叙述正确的是( )

 )可用合成一系列芳炔类大环化合物,其结构如下,有关叙述正确的是( )
)可用合成一系列芳炔类大环化合物,其结构如下,有关叙述正确的是( )
| A、上述四种物质属于苯乙炔的同系物 |
| B、第一种物质的分子式为C18H12 |
| C、它们可通过苯乙炔的加成反应获得 |
| D、该系列化合物的含碳量均相同 |
化学在生产和日常生活中有着重要的应用.下列说法正确是( )
| A、汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 |
| B、向煤中加入适量石灰石,使煤燃烧产生的SO2最终生成CaSO3,可减少对大气的污染 |
| C、高纯度的硅单质广泛用于制作光导纤维 |
| D、大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨 |
今有NH3、O2、NO2在标准状况下的混合气体20.16L,通过稀硫酸后,溶液质量增加了34.1g,气体缩小至2.24L(标况下),将余烬木条插入其中,木条不复燃,则原混合气中NH3、O2、NO2物质的量比为( )
| A、1:1:7 |
| B、2:2:5 |
| C、3:1:4 |
| D、5:2:2 |
