题目内容
 含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.
含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是
(2)现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.①若HA为HCN,该溶液显碱性,则溶液中c(Na+)
②若HA为CH3COOH,该溶液显酸性.溶液中所有的离子按浓度由大到小排列的顺序是
醋酸和盐酸是中学化学中常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
(1)常温下,在 pH=5的稀醋酸溶液中,c(CH3COO-)=
a.加入少量0.10mol?L-1的稀盐酸 b.加热CH3COOH溶液c.加水稀释至0.010mol?L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol?L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)
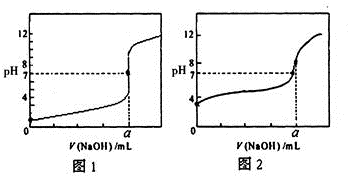
(3)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L
CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:
①NaOH溶液滴定CH3COOH溶液的曲线是
②a=
(4)常温下,将0.1mol/L盐酸和0.1mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为
(5)已知:90℃时,水的离子积常数为Kw=3.80×10-13,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:弱酸HA与其钠盐NaA的混合溶液,用作缓冲溶液,说明HA可以与碱反应,NaA可以与酸反应,使溶液遇到酸碱时pH变化不大;
(1)HA可以与碱反应,NaA可以与酸反应;
(2)①据溶液中的电荷守恒c(Na+)+c(H+)=c(CN-)+c(OH-)解答;
②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),结合溶液电中性原则分析;
(1)根据醋酸的电离平衡CH3COOH?H++CH3COO-和电荷守恒来计算,醋酸溶液中氢离子由醋酸和水电离;醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
(2)生成氢气的体积取决于酸的量的多少;
(3)①根据盐酸和醋酸在滴定开始时的pH来判断;
②据NaOH与HCl中和是物质的量之比为1:1计算a的值;
(4)溶液显中性,说明氢离子和氢氧根的浓度一定相等,醋酸钠是强碱弱酸盐,水解显碱性,根据电荷守恒来判断离子浓度大小关系;
(5)强酸和强碱混合后溶液的氢离子浓度可以根据中和反应的实质来计算.
(1)HA可以与碱反应,NaA可以与酸反应;
(2)①据溶液中的电荷守恒c(Na+)+c(H+)=c(CN-)+c(OH-)解答;
②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),结合溶液电中性原则分析;
(1)根据醋酸的电离平衡CH3COOH?H++CH3COO-和电荷守恒来计算,醋酸溶液中氢离子由醋酸和水电离;醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
(2)生成氢气的体积取决于酸的量的多少;
(3)①根据盐酸和醋酸在滴定开始时的pH来判断;
②据NaOH与HCl中和是物质的量之比为1:1计算a的值;
(4)溶液显中性,说明氢离子和氢氧根的浓度一定相等,醋酸钠是强碱弱酸盐,水解显碱性,根据电荷守恒来判断离子浓度大小关系;
(5)强酸和强碱混合后溶液的氢离子浓度可以根据中和反应的实质来计算.
解答:
解:(1)含有弱酸HA和其钠盐NaA的混合溶液,向其中加入少量酸或碱时,溶液的酸碱性变化不大,是由于加入酸时发生:A-+H+?HA,加入碱时发生:HA+OH-?H2O+A-,溶液中氢离子或氢氧根离子浓度变化不大而起到缓冲作用,
故答案为:A-+H+?HA;HA+OH-?H2O+A-;
(2)①该溶液显碱性,则c(H+)<c(OH-),根据溶液电中性原则可知c(Na+)+c(H+)=c(CN-)+c(OH-),则c(Na+)>c(CN-),
故答案为:>;因为c(Na+)+c(H+)=c(CN-)+c(OH-),溶液显碱性,则c(H+)<c(OH-),所以c(Na+)>c(CN-);
②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),根据溶液电中性原则可知c(CH3COO-)>c(Na+),弱电解质的电离使微弱的,所以c(Na+)>c(H+),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(1)在 pH=5的稀醋酸溶液中,c(H+)=10-5mol/L,则c(OH-)=10-9mol/L,根据醋酸溶液中电荷守恒可知:c(H+)═c(OH-)+c(CH3COO-),可以看出,c(CH3COO-)=c(H+)-c(OH-)=(10-5-10-9)mol/L;
醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
a.加入少量0.10mol?L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加水稀释至0.010mol?L-1,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故错误;
f.加入少量0.10mol?L-1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故正确;
故答案为:(10-5-10-9)mol/L;bcf;
(2)醋酸是弱酸,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,所以等体积且pH均等于3的醋酸和盐酸溶液中,剩余锌粉的为因素溶液,醋酸中剩余的为醋酸,所以醋酸产生的氢气体积较大,且反应速率快,
故答案为:<;<;
(3)①滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定醋酸的曲线是图2,故答案为:图2;
②HCl与NaOH反应时,物质的量之比为1:1,等浓度的盐酸和氢氧化钠中和时,其溶液体积比为1:1,所以a=20mL,故答案为:20;
(4)将0.1mol/L盐酸和0.1mol/L醋酸钠溶液混合,反应生成醋酸,如等体积混合物,溶液呈酸性,溶液呈中性,应加入少量盐酸,生成醋酸,则c(Na+)>c(CH3COO-)>c(Cl-)溶液恰好呈中性,氢离子和氢氧根的浓度一定相等,c(H+)=c(OH-),则有c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-),
故答案为:c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-);
(5)pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氢氧化钠溶液中c(OH-)=38×10-1410-11=38×10-3mol/L,混合后:H++OH-=H2O,所以碱剩余,剩余的氢氧根的浓度为c(OH-)=38×10-3-10-32=0.0185mol/L,所以c(H+)=38×10-140.0185≈2.05×10-11(mol/L),
故答案为:2.05×10-11.
故答案为:A-+H+?HA;HA+OH-?H2O+A-;
(2)①该溶液显碱性,则c(H+)<c(OH-),根据溶液电中性原则可知c(Na+)+c(H+)=c(CN-)+c(OH-),则c(Na+)>c(CN-),
故答案为:>;因为c(Na+)+c(H+)=c(CN-)+c(OH-),溶液显碱性,则c(H+)<c(OH-),所以c(Na+)>c(CN-);
②若HA为CH3COOH,该溶液显酸性,说明c(H+)>c(OH-),根据溶液电中性原则可知c(CH3COO-)>c(Na+),弱电解质的电离使微弱的,所以c(Na+)>c(H+),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(1)在 pH=5的稀醋酸溶液中,c(H+)=10-5mol/L,则c(OH-)=10-9mol/L,根据醋酸溶液中电荷守恒可知:c(H+)═c(OH-)+c(CH3COO-),可以看出,c(CH3COO-)=c(H+)-c(OH-)=(10-5-10-9)mol/L;
醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
a.加入少量0.10mol?L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加水稀释至0.010mol?L-1,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故错误;
f.加入少量0.10mol?L-1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故正确;
故答案为:(10-5-10-9)mol/L;bcf;
(2)醋酸是弱酸,随着它和金属的反应,电离平衡不断地向右移动,会电离出更多的氢离子,所以等体积且pH均等于3的醋酸和盐酸溶液中,剩余锌粉的为因素溶液,醋酸中剩余的为醋酸,所以醋酸产生的氢气体积较大,且反应速率快,
故答案为:<;<;
(3)①滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定醋酸的曲线是图2,故答案为:图2;
②HCl与NaOH反应时,物质的量之比为1:1,等浓度的盐酸和氢氧化钠中和时,其溶液体积比为1:1,所以a=20mL,故答案为:20;
(4)将0.1mol/L盐酸和0.1mol/L醋酸钠溶液混合,反应生成醋酸,如等体积混合物,溶液呈酸性,溶液呈中性,应加入少量盐酸,生成醋酸,则c(Na+)>c(CH3COO-)>c(Cl-)溶液恰好呈中性,氢离子和氢氧根的浓度一定相等,c(H+)=c(OH-),则有c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-),
故答案为:c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-);
(5)pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氢氧化钠溶液中c(OH-)=38×10-1410-11=38×10-3mol/L,混合后:H++OH-=H2O,所以碱剩余,剩余的氢氧根的浓度为c(OH-)=38×10-3-10-32=0.0185mol/L,所以c(H+)=38×10-140.0185≈2.05×10-11(mol/L),
故答案为:2.05×10-11.
点评:本题综合考查离子浓度大小比较以及酸碱混合的计算,侧重于盐类水解和弱电解质电离的考查,题目难度中等,注意结合电荷守恒解答和注意缓冲溶液的原理.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
下列关于离子反应的叙述中,错误的是( )
| A、溶液中发生的复分解反应肯定是离子反应 |
| B、离子反应并不一定要有水、有气体、有沉淀生成才能发生 |
| C、醋酸钠中滴入硫酸也能发生离子反应 |
| D、氯气和水的反应不属于离子反应 |
两种气态烃的混合气共0.1mol,在空气中完全燃烧得到0.16molCO2和3.6g水,下列说法正确的是( )
| A、一定含甲烷,不含乙烷 |
| B、一定含乙烷,不含甲烷 |
| C、一定是甲烷和乙烯的混合物 |
| D、一定含甲烷,但不含乙烯 |
下列有关实验的操作及描述不正确的是( )
| A、粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体 |
| B、用托盘天平称取10.5 g NaCl时应在右边托盘中放入10 g砝码 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、测定溶液pH的操作将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,然后与标准比色卡对照 |