题目内容
氧化锌是电镀、涂料、有机合成等化学工业的重要原料,某课题组设计由含锌工业废料(含铁、铜、锰等杂质)生产氧化锌的工艺流程如下:
含Zn废料
压缩空气浸取液
的氧化液
还原液
碳化
ZnO
浸取液下有箭头指向黄钠铁钒(NaFe3(SO4)(OH)6);氧化液下有箭头指向MnO(OH)2等;还原液下有箭头指向海绵Cu; 碳化下有箭头指向滤液.
已知:黄钠铁钒在PH为15,温度为90℃时完全沉淀,且易于过滤.
(1)步骤①的浸取液里除含有Zn2+、Mn2+外,含有的金属离子有 , ,所加试剂X为Na2SO4和 的混合液;
(2)步骤②可进一步氧化除铁,还氧化除去了Mn2+,试写出相应的除去Mn2+的离子方程式 ,步骤③加入的试剂是 ,整个工艺流程中可以循环使用的试剂是 ;
(3)步骤⑤中检验沉淀是否洗涤干净的操作方法是 ;
(4)步骤④碳化实际得到的是一种碱式碳酸锌[ZnCO3?xZn(OH)2?yH2O],取该样品6.82g,充分灼烧后测得残留物质量为4.86g,将所得气体通入足量澄清石灰水中,得到2.00g沉淀,则此碱式碳酸锌的化学式是 .
含Zn废料
| ①试剂X |
| ②10%H2O |
| PH=5.5 |
| ③试剂Y |
| ④Na2CO3 |
| ⑤洗涤 |
| 焙烧 |
浸取液下有箭头指向黄钠铁钒(NaFe3(SO4)(OH)6);氧化液下有箭头指向MnO(OH)2等;还原液下有箭头指向海绵Cu; 碳化下有箭头指向滤液.
已知:黄钠铁钒在PH为15,温度为90℃时完全沉淀,且易于过滤.
(1)步骤①的浸取液里除含有Zn2+、Mn2+外,含有的金属离子有
(2)步骤②可进一步氧化除铁,还氧化除去了Mn2+,试写出相应的除去Mn2+的离子方程式
(3)步骤⑤中检验沉淀是否洗涤干净的操作方法是
(4)步骤④碳化实际得到的是一种碱式碳酸锌[ZnCO3?xZn(OH)2?yH2O],取该样品6.82g,充分灼烧后测得残留物质量为4.86g,将所得气体通入足量澄清石灰水中,得到2.00g沉淀,则此碱式碳酸锌的化学式是
考点:物质的分离、提纯和除杂,制备实验方案的设计
专题:实验题
分析:铁、铜、锰能与盐酸反应生成Fe2+、Zn2+、Mn2+;Mn2+可与双氧水反应生成MnO(OH)2↓;锌能与铜离子反应生成铜单质;硫酸锌能与碳酸钠反应生成硫酸钠和碳酸锌,碳酸锌受热分解生成氧化锌和水.
(1)铁、铜、锰能与盐酸反应生成Fe2+、Zn2+、Mn2+;
(2)Mn2+可与双氧水反应生成MnO(OH)2↓;锌能与铜离子反应生成铜单质;硫酸锌能与碳酸钠反应生成硫酸钠和碳酸锌;
(3)滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净;
(4)碱式碳酸锌6.82 g,充分灼烧后测得残留物质为氧化锌,质量为4.86 g,锌的质量为3.9g.将所得气体是二氧化碳,沉淀碳酸钙是2.0 g,物质的量为0.02mol.碳酸根的物质的量为0.02mol.根据电荷守恒得氢氧根的物质的量为X=0.08mol.由碱式碳酸锌6.82 g减去锌的质量,碳酸根和氢氧根的质量,剩下的就为水的质量.
(1)铁、铜、锰能与盐酸反应生成Fe2+、Zn2+、Mn2+;
(2)Mn2+可与双氧水反应生成MnO(OH)2↓;锌能与铜离子反应生成铜单质;硫酸锌能与碳酸钠反应生成硫酸钠和碳酸锌;
(3)滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净;
(4)碱式碳酸锌6.82 g,充分灼烧后测得残留物质为氧化锌,质量为4.86 g,锌的质量为3.9g.将所得气体是二氧化碳,沉淀碳酸钙是2.0 g,物质的量为0.02mol.碳酸根的物质的量为0.02mol.根据电荷守恒得氢氧根的物质的量为X=0.08mol.由碱式碳酸锌6.82 g减去锌的质量,碳酸根和氢氧根的质量,剩下的就为水的质量.
解答:
解:(1)铁、铜、锰能与盐酸反应生成Fe2+、Zn2+、Mn2+,Fe2+能被氧化为Fe3+,浸取液课得到黄钠铁钒,说明X为Na2SO4和H2SO4的混合液,故答案为:Fe3+;Cu2+;H2SO4;
(2)Mn2+可与双氧水反应生成MnO(OH)2↓,离子方程式:Mn2++H2O2+H2O═MnO(OH)2↓+2H+;锌能与铜离子反应生成铜单质;硫酸锌能与碳酸钠反应生成硫酸钠和碳酸锌,Na2SO4可以循环使用,
故答案为:Mn2++H2O2+H2O═MnO(OH)2↓+2H+;Zn;Na2SO4;
(3)取最后一次洗涤滤液滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净,故答案为:取最后一次洗涤滤液1~2mL于试管中,向其中滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净;
(4)碱式碳酸锌6.82 g,充分灼烧后测得残留物质为氧化锌,质量为4.86 g,物质的量为
=0.06mol,锌的质量为3.9g.将所得气体是二氧化碳,沉淀碳酸钙是2.0 g,物质的量为0.02mol.碳酸根的物质的量为0.02mol.
根据电荷守恒0.06mol×2=0.02mol×2+X
得氢氧根的物质的量为X=0.08mol.
由碱式碳酸锌6.82 g减去锌的质量,碳酸根和氢氧根的质量,剩下的就为水的质量:6.82-3.9-0.02×60-0.08×17=0.36g,物质的量为0.02mol.
故碱式碳酸锌的组成ZnCO3?2Zn(OH)2?H2O 或Zn3(OH)4CO3?H2O,
故答案为:ZnCO3?2Zn(OH)2?H2O.
(2)Mn2+可与双氧水反应生成MnO(OH)2↓,离子方程式:Mn2++H2O2+H2O═MnO(OH)2↓+2H+;锌能与铜离子反应生成铜单质;硫酸锌能与碳酸钠反应生成硫酸钠和碳酸锌,Na2SO4可以循环使用,
故答案为:Mn2++H2O2+H2O═MnO(OH)2↓+2H+;Zn;Na2SO4;
(3)取最后一次洗涤滤液滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净,故答案为:取最后一次洗涤滤液1~2mL于试管中,向其中滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净;
(4)碱式碳酸锌6.82 g,充分灼烧后测得残留物质为氧化锌,质量为4.86 g,物质的量为
| 4.86 |
| 81 |
根据电荷守恒0.06mol×2=0.02mol×2+X
得氢氧根的物质的量为X=0.08mol.
由碱式碳酸锌6.82 g减去锌的质量,碳酸根和氢氧根的质量,剩下的就为水的质量:6.82-3.9-0.02×60-0.08×17=0.36g,物质的量为0.02mol.
故碱式碳酸锌的组成ZnCO3?2Zn(OH)2?H2O 或Zn3(OH)4CO3?H2O,
故答案为:ZnCO3?2Zn(OH)2?H2O.
点评:本题考查制备实验方案的设计,涉及为高考不变的一个题型,每年高考必考,是热点题型、也是高考难点之一.本题主要考查了氧化还原反应和离子反应方程式的书写、化学式的判断,难度中等.

练习册系列答案
相关题目
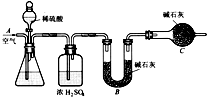
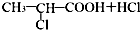
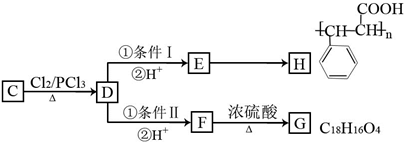
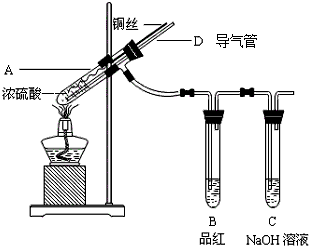 某同学为了探究铜与浓硫酸的反应,进行了如下实验.
某同学为了探究铜与浓硫酸的反应,进行了如下实验.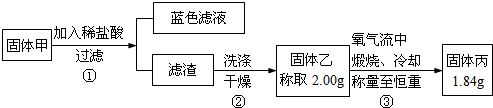


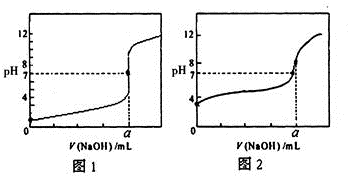 含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.
含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.