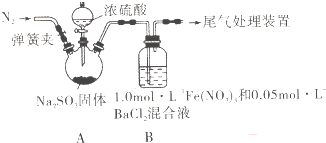
题目内容
一切植物中均含有天然有机高分子化合物A,它是构成植物细胞壁的基础物质,不溶于水,也不溶于一般的有机溶剂.各物质之间的转化关系如下所示(A~F均分别代表一种物质,部分产物略去):
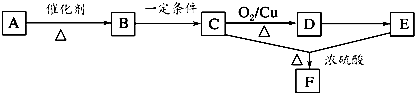
已知:B生成C的同时还有CO2生成.请回答下列问题:
(1)由A生成B的化学方程式为 .
(2)B、C均含有的官能团名称是 .
(3)A→F发生反应的反应类型有 (填序号).
A.氧化反应 B.酯化反应
C.加成反应 D.水解反应
(4)写出C→D所发生反应的化学方程式: .
(5)F有多种同分异构体,请写出与它具有相同官能团且能发生银镜反应的所有同分异构体 .

已知:B生成C的同时还有CO2生成.请回答下列问题:
(1)由A生成B的化学方程式为
(2)B、C均含有的官能团名称是
(3)A→F发生反应的反应类型有
A.氧化反应 B.酯化反应
C.加成反应 D.水解反应
(4)写出C→D所发生反应的化学方程式:
(5)F有多种同分异构体,请写出与它具有相同官能团且能发生银镜反应的所有同分异构体
考点:有机物的推断
专题:有机物的化学性质及推断
分析:构成细胞壁的天然高分子化合物为纤维素,则A的结构简式为(C6H10O5)n,纤维素水解最终生成葡萄糖,则B结构简式为HOH2C(CHOH)4CHO,B反应生成C,C和E在浓硫酸、加热条件下发生酯化反应,则C结构简式为CH3CH2OH,D结构简式为CH3CHO、E结构简式为CH3COOH、F结构简式为CH3COOCH2CH3,据此分析解答.
解答:
解:构成细胞壁的天然高分子化合物为纤维素,则A的结构简式为(C6H10O5)n,纤维素水解最终生成葡萄糖,则B结构简式为HOH2C(CHOH)4CHO,B反应生成C,C和E在浓硫酸、加热条件下发生酯化反应,则C结构简式为CH3CH2OH,D结构简式为CH3CHO、E结构简式为CH3COOH、F结构简式为CH3COOCH2CH3,
(1)A是纤维素、B是葡萄糖,纤维素在催化剂、加热条件下水解生成葡萄糖,反应方程式为(C6H10O5)n(纤维素)+nH2O
nC6H12O6(葡萄糖),故答案为:(C6H10O5)n(纤维素)+nH2O
nC6H12O6(葡萄糖);
(2)B结构简式为HOH2C(CHOH)4CHO、C结构简式为CH3CH2OH,则B和C中都含有的官能团是羟基,故答案为:羟基;
(3)A发生水解反应生成B,B发酵生成乙醇,乙醇被氧化生成乙醛,乙醛被氧化生成乙酸,乙醇和乙酸发生酯化反应生成乙酸乙酯,所以发生的反应有水解反应、氧化反应、取代反应或酯化反应,故选ABD;
(4)C是乙醇、D是乙醛,乙醇发生氧化反应生成乙醛,反应方程式为2C2H5OH+O2
2CH3CHO+2H2O,
故答案为:2C2H5OH+O2
2CH3CHO+2H2O;
(5)F为乙酸乙酯,F的同分异构体与它具有相同官能团且能发生银镜反应,说明其同分异构体中含有甲酯基,则烷基可能是-CH2CH2CH3或-CH(CH3)2,其结构简式为HCOOCH2CH2CH3、HCOO CH(CH3)2,故答案为:HCOOCH2CH2CH3、HCOO CH(CH3)2.
(1)A是纤维素、B是葡萄糖,纤维素在催化剂、加热条件下水解生成葡萄糖,反应方程式为(C6H10O5)n(纤维素)+nH2O
| 催化剂 |
| △ |
| 催化剂 |
| △ |
(2)B结构简式为HOH2C(CHOH)4CHO、C结构简式为CH3CH2OH,则B和C中都含有的官能团是羟基,故答案为:羟基;
(3)A发生水解反应生成B,B发酵生成乙醇,乙醇被氧化生成乙醛,乙醛被氧化生成乙酸,乙醇和乙酸发生酯化反应生成乙酸乙酯,所以发生的反应有水解反应、氧化反应、取代反应或酯化反应,故选ABD;
(4)C是乙醇、D是乙醛,乙醇发生氧化反应生成乙醛,反应方程式为2C2H5OH+O2
| Cu |
| △ |
故答案为:2C2H5OH+O2
| Cu |
| △ |
(5)F为乙酸乙酯,F的同分异构体与它具有相同官能团且能发生银镜反应,说明其同分异构体中含有甲酯基,则烷基可能是-CH2CH2CH3或-CH(CH3)2,其结构简式为HCOOCH2CH2CH3、HCOO CH(CH3)2,故答案为:HCOOCH2CH2CH3、HCOO CH(CH3)2.
点评:本题考查有机物推断,涉及高分子化合物、醇、醛、羧酸和酯之间的转化,明确有机物中的官能团及其性质是解本题关键,知道常见有机反应类型及反应条件,题目难度不大.

练习册系列答案
相关题目


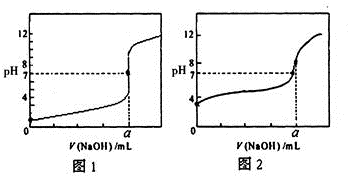 含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.
含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.