题目内容
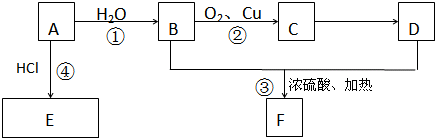
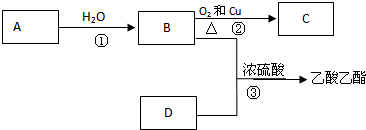
A是一种重要的化工原料,其产量可以用来衡量一个国家的石油化工水平,C是一种酸性物质,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如图转化关系(石蜡油含17个碳原子以上的液态烷烃,部分反应条件、产物被省略).
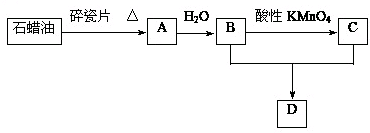
(1)工业上,由石油获得汽油、煤油、石蜡油等成份的方法是 ,A的结构简式 ;B的分子式 .
(2)B中官能团的名称 ;C中官能团的结构简式为 ;A→B的反应类型是 ;B+C→D的反应类型是 .
(3)有机反应中,条件不同往往反应产物也不同.题中B转化为C时,B发生了氧化反应,请写出已学过的B在一定条件下发生氧化反应,转化为另一种烃的衍生物的化学方程式 .
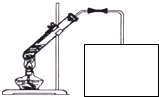
(4)写出B+C转化为D 的化学方程式 ,实验室常用如图所示装置制取D,请在下图所示方框中补充画出有关仪器,并标明所盛药品的名称.
(5)丁烷和戊烷等烷烃是石蜡油获得A的过程中的中间产物.
①请写出丁烷的所有同分异构体的结构简式 .
②戊烷的一种同分异构体,它的一氯取代物有4种,则这种同分异构体的结构简式为 .

(1)工业上,由石油获得汽油、煤油、石蜡油等成份的方法是
(2)B中官能团的名称
(3)有机反应中,条件不同往往反应产物也不同.题中B转化为C时,B发生了氧化反应,请写出已学过的B在一定条件下发生氧化反应,转化为另一种烃的衍生物的化学方程式
(4)写出B+C转化为D 的化学方程式

(5)丁烷和戊烷等烷烃是石蜡油获得A的过程中的中间产物.
①请写出丁烷的所有同分异构体的结构简式
②戊烷的一种同分异构体,它的一氯取代物有4种,则这种同分异构体的结构简式为
考点:有机物的推断
专题:
分析:A是一种重要的化工原料,其产量可以用来衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生氧化反应生成C,C是一种酸性物质,则C为CH3COOH,乙醇与乙酸发生酯化反应生成D为CH3COOCH2CH3,据此解答.
解答:
解:A是一种重要的化工原料,其产量可以用来衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生氧化反应生成C,C是一种酸性物质,则C为CH3COOH,乙醇与乙酸发生酯化反应生成D为CH3COOCH2CH3,
(1)工业上,利用沸点不同由石油获得汽油、煤油、石蜡油等成份,分离方法是:分馏;A为CH2=CH2,B为乙醇,分子式为C2H6O,故答案为:分馏;CH2=CH2;C2H6O;
(2)B为CH3CH2OH,含有官能团为羟基,C为CH3COOH,官能团为羧基,结构简式为:-COOH,A→B是乙烯发生加成反应生成乙醇,B+C→D是乙酸与乙醇发生酯化反应生成乙酸乙酯,也属于取代反应,故答案为:羟基;-COOH;加成反应;酯化反应或取代反应;
(3)有机反应中,条件不同往往反应产物也不同.题中乙醇转化为乙酸时,B(乙醇)发生了氧化反应,乙醇在一定条件下发生氧化反应生成乙醛,反应方程式为:2CH3CH2OH+O2
2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O;
(4)B+C转化为D是乙酸与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O,实验室常用图中所示装置制取乙酸乙酯,用饱和碳酸钠溶液吸收乙醇、乙酸,降低乙酸乙酯的溶解度,便于分层,要防止倒吸,所示方框中有关仪器及所盛药品为: ,
,
故答案为:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O; ;
;
(5)①丁烷的所有同分异构体的结构简式有:CH3CH2CH2CH3、CH(CH3)3,故答案为:CH3CH2CH2CH3、CH(CH3)3;
②戊烷的一种同分异构体,它的一氯取代物有4种,则这种同分异构体的结构简式为:CH3CH2CH(CH3)2,故答案为:CH3CH2CH(CH3)2.
(1)工业上,利用沸点不同由石油获得汽油、煤油、石蜡油等成份,分离方法是:分馏;A为CH2=CH2,B为乙醇,分子式为C2H6O,故答案为:分馏;CH2=CH2;C2H6O;
(2)B为CH3CH2OH,含有官能团为羟基,C为CH3COOH,官能团为羧基,结构简式为:-COOH,A→B是乙烯发生加成反应生成乙醇,B+C→D是乙酸与乙醇发生酯化反应生成乙酸乙酯,也属于取代反应,故答案为:羟基;-COOH;加成反应;酯化反应或取代反应;
(3)有机反应中,条件不同往往反应产物也不同.题中乙醇转化为乙酸时,B(乙醇)发生了氧化反应,乙醇在一定条件下发生氧化反应生成乙醛,反应方程式为:2CH3CH2OH+O2
| Cu |
| △ |
故答案为:2CH3CH2OH+O2
| Cu |
| △ |
(4)B+C转化为D是乙酸与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3CH2OH+CH3COOH
| 浓硫酸 |
| △ |
 ,
,故答案为:CH3CH2OH+CH3COOH
| 浓硫酸 |
| △ |
 ;
;(5)①丁烷的所有同分异构体的结构简式有:CH3CH2CH2CH3、CH(CH3)3,故答案为:CH3CH2CH2CH3、CH(CH3)3;
②戊烷的一种同分异构体,它的一氯取代物有4种,则这种同分异构体的结构简式为:CH3CH2CH(CH3)2,故答案为:CH3CH2CH(CH3)2.
点评:本题考查有机物推断、乙酸乙酯制备、同分异构体书写等,涉及烯与醇、醛、羧酸之间的转化关系等,难度不大,注意基础知识的理解掌握.

练习册系列答案
相关题目
 含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.
含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.