题目内容
3.下列有机物有多个官能团:A.
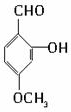
B.
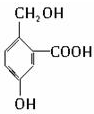
C.
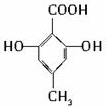
D.
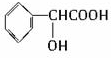
E.CH2=CHCOOCH=CHCOOCH=CH2
(1)可以看作醇类的是(填入编号)BD.
(2)可以看作酚类的是ABC.
(3)可以看作羧酸类的是BCD.
(4)可以看作酯类的是E.
分析 根据分子中的官能团分析,含有-OH的为醇类物质,若-OH直接和苯环相连则为酚类物质;含有羧基的属于羧酸;含有-COO-的为酯类物质.据此分析.
解答 解:有机物A的结构简式为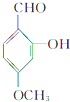 ,其分子中的官能团有醛基(-CHO),酚羟基,醚基(-O-);
,其分子中的官能团有醛基(-CHO),酚羟基,醚基(-O-);
有机物B的结构简式为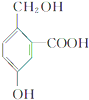 ,其分子中的官能团有羧基(-COOH),酚羟基,醇羟基;
,其分子中的官能团有羧基(-COOH),酚羟基,醇羟基;
有机物C的结构简式为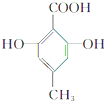 ,其分子中的官能团有羧基(-COOH),酚羟基;
,其分子中的官能团有羧基(-COOH),酚羟基;
有机物D的结构简式为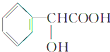 ,其分子中的官能团有羧基(-COOH),醇羟基;
,其分子中的官能团有羧基(-COOH),醇羟基;
有机物E的结构简式为 ,其分子中的官能团有酯基(-COO-);
,其分子中的官能团有酯基(-COO-);
(1)可以看作醇类的是BD;故答案为:BD;
(2)可以看作酚类的是ABC;故答案为:ABC;
(3)可以看作羧酸类的是BCD;故答案为:BCD;
(4)可以看作酯类的是E;故答案为:E.
点评 本题考查有机物的结构与有机物的分类,注意-OH与苯环直接相连的有机物属于酚,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
9.下列关于乙烯和聚乙烯的叙述不正确的是( )
| A. | 乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 | |
| B. | 可以采用通过溴水洗气的方法以除去乙烷中的乙烯气体 | |
| C. | 乙烯和聚乙烯都能使溴水褪色 | |
| D. | 取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
15.下列有关化学用语使用正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | CO2的比例模型  | ||
| C. | 甲基的电子式: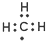 | D. | 硬脂酸的化学式:C17H33COOH |
12.已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
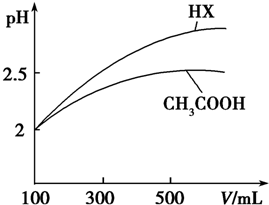
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c (OH-)=2c(H2CO3)+c(HCO3-)+c(H+);②c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-).
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |

(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c (OH-)=2c(H2CO3)+c(HCO3-)+c(H+);②c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-).
13. 如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
 如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法判断 |
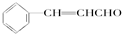 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的: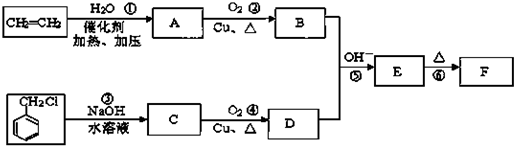
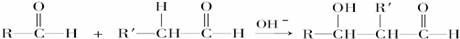
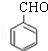 ;
;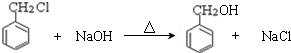 ,判断有关反应的类型:⑥消去反应;
,判断有关反应的类型:⑥消去反应;