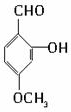
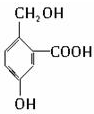
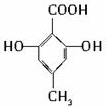
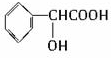
题目内容
13. 如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法判断 |
分析 铜球所受的F浮力=ρVg,铜球所受的拉力=铜球的重力-铜球所受的浮力=铜球的重力-ρVg,往稀硫酸投入铁片后溶液质量增大,据此分析铜球所受的拉力变化情况.
解答 解:铁与稀硫酸反应对溶液质量的影响如下:
Fe+H2SO4=FeSO4+H2↑ 增加的质量
56 2 56-2=54
1molFe与硫酸反应,溶液的质量会增加54g,溶液质量增加,但溶液的体积几乎不变,因此溶液的密度就会增大,
铜球所受的F浮力=ρVg,
铜球所受的拉力=铜球的重力-铜球所受的浮力=铜球的重力-ρVg,
由于溶液的密度增大,因此铜球所受的拉力减小,
故选B.
点评 本题考查了化学计算,题目难度不大,明确发生反应实质为解答关键,注意反应前后溶液密度变化,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
4.以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol的说法中,正确的是( )
| A. | 有10NA个电子转移时,放出1300kJ的能量 | |
| B. | 有1NA个水分子生成且为液体时,吸收1300kJ的能量 | |
| C. | 有2NA个碳氧共用电子对生成时,放出1300kJ的能量 | |
| D. | 有8NA个碳氧共用电子对生成时,吸收1300kJ的能量 |
8.Ⅰ.有硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
(2)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(3)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1 mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | t3 |
(3)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
18.在 KNO3+S+C→K2S+N2+CO2反应中,被1mol KNO3氧化的碳的质量是( )
| A. | 21g | B. | 18g | C. | 15g | D. | 12g |