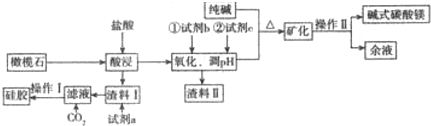
题目内容
18.某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成,取该溶液进行如下实验:(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(C)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出.
根据上述实验回答下列问题.
(1)溶液中一定不存在的离子是MnO4-、Ag+、Ba2+、Al3+;
(2)一定存在的离子是Na+、AlO2-、CO32-;写出产生沉淀甲的离子方程式:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(3)判断沉淀乙成分的方法是加入盐酸,观察沉淀是否全部溶解,若全部溶解,说明只有BaCO3,若部分溶解则还含有BaSO4.
分析 无色溶液,一定不含紫色的MnO4-,
由A可知,气体为二氧化碳,则一定含CO32-,与CO32-反应的Ag+、Ba2+、Al3+不能大量存在;
由B可知,Al3+、HCO3-相互促进生成气体甲为二氧化碳,沉淀甲为氢氧化铝,则原溶液一定含AlO2-;
由C可知,气体为铵根离子与碱反应生成的氨气,沉淀乙中一定含碳酸钡,可能含硫酸钡,以此来解答.
解答 解:无色溶液,一定不含紫色的MnO4-,
由A可知,气体为二氧化碳,则一定含CO32-,与CO32-反应的Ag+、Ba2+、Al3+不能大量存在;
由B可知,Al3+、HCO3-相互促进生成气体甲为二氧化碳,沉淀甲为氢氧化铝,则原溶液一定含AlO2-;
由C可知,气体为铵根离子与碱反应生成的氨气,沉淀乙中一定含碳酸钡,可能含硫酸钡,
(1)溶液中一定不存在的离子是MnO4-、Ag+、Ba2+、Al3+,故答案为:MnO4-、Ag+、Ba2+、Al3+;
(2)由以上分析可知一定存在的离子是CO32-、Na+、AlO2-,B中生成沉淀甲的离子方程式是为Al3++3 HCO3-=3 CO2↑+Al (OH)3↓,
故答案为:Na+、AlO2-、CO32-;Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(3)白色沉淀乙一定含有碳酸钡,可能含有硫酸钡,可加入盐酸检验,如沉淀部分溶解,则含有碳酸钡和硫酸钡,如沉淀全部溶解,则只含碳酸钡,
故答案为:加入盐酸,观察沉淀是否全部溶解,若全部溶解,说明只有BaCO3,若部分溶解则还含有BaSO4.
点评 本题考查无机物的推断,为高频考点,把握离子的颜色、离子之间的反应为解答的关键,侧重分析与推断能力的考查,注意水解原理应用,题目难度不大.

练习册系列答案
相关题目
4.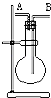 某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )
某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )
 某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )
某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:①H2; ②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2.下列说法正确的是( )| A. | 烧瓶是干燥的,由B进气,可收集②③④⑥⑦ | |
| B. | 烧瓶是干燥的,由A进气,可收集①⑤ | |
| C. | 在烧瓶中充满水,由A进气,可收集①⑤⑦ | |
| D. | 在烧瓶中充满水,由B进气,可收集⑥ |
6.下列叙述正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 直径介于1nm-100nm之间的微粒称为胶体 | |
| C. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 | |
| D. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
13.图表归纳是学习化学的常用方法,某同学归纳的下表物质与图中对应关系正确的是( )
| 选项 | X | Y | Z |  |
| A | 含氧酸 | 一元强酸 | HclO4 | |
| B | 易溶碱 | 强碱 | NaOH | |
| C | 盐 | 酸式盐 | NaHCO3 | |
| D | 非电解质 | 氧化物 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
8.Ⅰ.有硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO4-转化为Mn2+.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
(2)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(3)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1 mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | t3 |
(3)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |

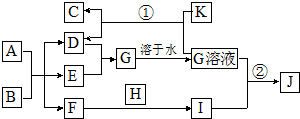 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,K是黑色固体,D和F反应可用于工业上生产漂白液,H可用于制造光导纤维,J是一种乳白色凝胶状沉淀.(部分生成物和反应条件未列出)