题目内容
16.侯氏制碱法是将CO2通入含NH3的饱和NaCl溶液中,结晶,析出NaHCO3,过滤,将NaHCO3加热分解制得Na2CO3.母液加入NaCl,通入NH3,降温,结晶析出NH4Cl,使母液又成为含NH3的饱和NaCl溶液.下列说法错误的是( )| A. | 侯氏制碱法的主要原料是NaCl、CO2和NH3 | |
| B. | Na2CO3的热稳定性低于NaHCO3 | |
| C. | 该方法的副产物是NH4Cl | |
| D. | 母液可循环利用 |
分析 二氧化碳在水溶液中溶解度小,生成碳酸氢钠少,不能析出晶体,氨化的饱和氯化铵溶液中通入过量二氧化碳,发生反应二氧化碳和氨水反应生成碳酸氢铵,碳酸氢铵和氯化钠反应,由于碳酸氢钠溶解度小,所以先生成碳酸氢钠晶体析出,母液加入NaCl,通入NH3,降温,结晶析出NH4Cl,使母液又成为含NH3的饱和NaCl溶液.循环利用;
解答 解:A.侯氏制碱法是将CO2通入含NH3的饱和NaCl溶液中,结晶,析出NaHCO3,过滤,将NaHCO3加热分解制得Na2CO3.主要原料是NaCl、CO2和NH3,故A正确;
B.碳酸氢钠受热分解,碳酸钠不分解,所以Na2CO3的热稳定性高于NaHCO3,故B错误;
C.氨化的饱和氯化铵溶液中通入过量二氧化碳,发生反应二氧化碳和氨水反应生成碳酸氢铵,碳酸氢铵和氯化钠反应,由于碳酸氢钠溶解度小,所以先生成碳酸氢钠晶体析出;在氨饱和NaCl溶液中通入CO2的两步反应方程式为:CO2+NH3+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl,副产物是NH4Cl,故C正确;
D.母液加入NaCl,通入NH3,降温,结晶析出NH4Cl,使母液又成为含NH3的饱和NaCl溶液.可以循环使用,故D正确;
故选B.
点评 本题考查了纯碱工业制备原理分析比较,反应实质的应用,试剂的作用,理解生产原理和过程的实质是解题关键,题目难度中等.

练习册系列答案
相关题目
5.月球土壤中含有H、He、S、Cl、Si、Na、Mg等多种元素,是人未来的资源宝库.
(1)Si位于元素周期表第三周期IV族;3He原子核内的中子数为1;
(2)用“>”或“<”填空:
(3)月球上某矿石经处理得到的MgO中含有少量SiO2,MgO和SiO2的晶体类型分别是离子晶体、原子晶体;
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取.写出该反应的离子方程式2ClO2-+Cl2=2ClO2+2Cl-.
(1)Si位于元素周期表第三周期IV族;3He原子核内的中子数为1;
(2)用“>”或“<”填空:
| 离子半径 | 第一电力能 | 熔点 | 酸性 |
| O2->Na+ | Si<S | NaCl<NaF | HClO4>H2SO4 |
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取.写出该反应的离子方程式2ClO2-+Cl2=2ClO2+2Cl-.
11. 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CO+4OH--2e-=CO32-+2H2O.
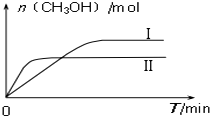
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);测得CH3OH的物质的量随时间的变化图:
①由图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.4<n(c)≤1.
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是a b.
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个C-H形成
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g).二甲醚可用作直接燃料电池,1mol二甲醚分子经过电化学氧化,可以产生12NA个电子的电量;根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);测得CH3OH的物质的量随时间的变化图:
①由图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是a b.
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个C-H形成
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g).二甲醚可用作直接燃料电池,1mol二甲醚分子经过电化学氧化,可以产生12NA个电子的电量;根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
1.下列有机物的命名及名称书写均正确的是( )
| A. | CH2BrCH2Br 二溴乙烷 | B. | CH3OOCCH3 乙酸甲酯 | ||
| C. |  硬酯酸甘油脂 硬酯酸甘油脂 | D. | 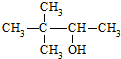 2,2二甲基-3-丁醇 2,2二甲基-3-丁醇 |
8.根据以下叙述和元素周期表的有关知识,回答下题:主族元素的性质主要由其原子的最外层电子数和电子层数决定,若元素的最外层电子数为m,电子层数为n,一般具有这样的规律:m>n的元素为非金属元素,m≤n的元素为金属元素.下列有关推断符合实际的是( )
| A. | 第n周期的最后一种金属元素处在第n主族(n>1) | |
| B. | m=1与m=7的元素单质相互化合时,都能形成离子化合物 | |
| C. | 第n周期有8-n种非金属元素(n>1,包括稀有气体元素) | |
| D. | m-n=5的主族元素存在本周期最强的对应含氧酸 |
5.实验室对下列药品的保存方法错误的是( )
| A. | 少量碳酸钙固体放在广口瓶中 | |
| B. | 少量浓硝酸放在棕色细口瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 少量氢氧化钠溶液保存在带玻璃塞的试剂瓶中 |
6.锰是冶炼工业中常用的添加剂.以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下,已知25℃,部分物质的溶度积常数如下:
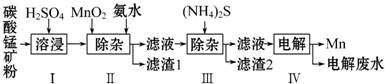
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是MnCO3+H2SO4=MnSO4+CO2↑+H2O.
(2)步骤Ⅱ中,MnO2在酸性条件下将Fe2+氧化为Fe3+,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(3)步骤Ⅲ中,滤渣2的主要成分是CoS和NiS.
(4)步骤Ⅳ中,在阴(填“阴”或“阳”)极析出Mn,电极反应为Mn2++2e-=Mn.
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 |
| 物质 | MnS | CoS | NiS |
| Ksp | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |

(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是MnCO3+H2SO4=MnSO4+CO2↑+H2O.
(2)步骤Ⅱ中,MnO2在酸性条件下将Fe2+氧化为Fe3+,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(3)步骤Ⅲ中,滤渣2的主要成分是CoS和NiS.
(4)步骤Ⅳ中,在阴(填“阴”或“阳”)极析出Mn,电极反应为Mn2++2e-=Mn.