题目内容
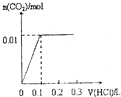
4.氢气是清洁能源,也是重要的化工原料.(1)已知H2S高温热分解制H2的反应为H2S(g)?H2(g)+$\frac{1}{2}$S2(g),在体积为2L的恒容密闭容器中,通入3.5mol H2S,控制不同温度进行H2S的分解实验,测得H2S的平衡转化率与温度的关系如图1所示.
①985℃时,反应经7min达到平衡,则上述反应从起始至7min内的反应速率v(S2)=0.05molL-1min-1.
②反应S2(g)+2H2(g)?2H2S(g)的△H<(填“>”或“<”)0.
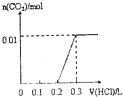
(2)使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如图2所示.
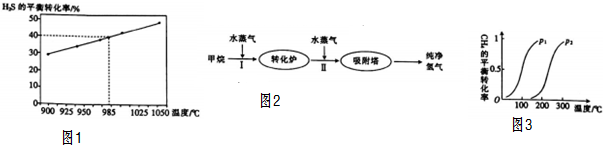
①此流程的第Ⅰ步反应为CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图3所示,则p1<(填“<”“>”或“=”)p2.
②100℃时,将3mol CH4和4mol H2O通入容积为100L的恒密闭容器中,达到平衡时容器中CO(g)和H2O(g)的浓度相同.100℃时该反应的平衡常数K=0.0216.
分析 (1)①根据在985℃时,H2S的转化率为40%,即可求出H2S的物质的量的变化量,然后根据在反应中,物质的量的变化量之比等于计量数之比,即可求出S2的物质的量的变化量,然后根据v=$\frac{△c}{△t}$来计算反应速率.
②据图可知,温度越高,H2S的平衡转化率越高,则说明升高温度,反应H2S=H2(g)+$\frac{1}{2}$S2(g)平衡右移,反应吸热;
(2)①由图可知温度相同时,到达平衡时,压强为P1的CH4转化率高,反应为气体体积增大的反应,减小压强平衡向体积增大的方向移动,据此分析;
②依据化学平衡三段式列式计算平衡浓度结合平衡常数K=$\frac{c(CO)c{\;}^{3}(H{\;}_{2})}{c(CH{\;}_{4})c(H{\;}_{2}O)}$计算得到.
解答 解:(1)①985℃时,H2S的转化率为40%,H2S的物质的量的变化量△n=3.5mol×40%=1.4mol,在反应中,物质的量的变化量之比等于计量数之比,故S2的物质的量的变化量△n=$\frac{1}{2}$×1.4moL=0.7mol,故反应速率v(S2)=$\frac{△c}{△t}$=$\frac{\frac{0.7}{2}}{7}$=0.05mol/(L•min),
故答案为:0.05 mol L-1min -1;
②据图可知,温度越高,H2S的平衡转化率越高,则说明升高温度,反应H2S=H2(g)+$\frac{1}{2}$S2(g)平衡右移,反应吸热,故反应S2(g)+2H2(g)=2H2S(g)放热,即△H<0,故答案为:<;
(2)①由图可知温度相同时,到达平衡时,压强为P1的CH4转化率高,平衡向正反应方向移动,又反应为气体体积增大的反应,则减小压强平衡向正反应方向移动,所以P1<P2;故答案为:<;
②100℃时,将3mol CH4和4mol H2O通入容积为100L的恒容密闭容器中,CO(g)和H2O(g))的浓度相同,
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L) 0.03 0.04 0 0
变化量(mol/L) 0.02 0.02 0.02 0.06
平衡量(mol/L) 0.01 0.02 0.02 0.06
平衡常数K=$\frac{c(CO)c{\;}^{3}(H{\;}_{2})}{c(CH{\;}_{4})c(H{\;}_{2}O)}$=$\frac{0.02×0.06{\;}^{3}}{0.01×0.02}$=0.0216;
故答案为:0.0216.
点评 本题综合考查化学平衡的计算,为高考常见题型和高频考点,侧重考查学生的分析、计算能力,涉及利用盖斯定律来解题和反应速率的求算、平衡的计算以及利用温度对平衡转化率的影响来分析反应吸热还是放热等,难度不大.

| A. | Ag2S | B. | HgS | C. | HgCl2 | D. | AgCl |
| A. | 氧化钠 | B. | 溴化钾 | C. | 次氯酸钙 | D. | 碘化钾 |
 铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:
铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.006mol/(L•min);
(3)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2. K2FeO4在处理水的过程中所起的作用有杀菌消毒、净水(吸附悬浮物);
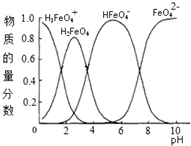
(4)高铁酸钾水溶液中FeO42-的存在形态及它们的物质的量分数随pH的变化如图所示:
(1)pH=2时溶液存在如下等量关系:c(K+)=2c(H2FeO4)+2c(H3FeO4+)+2c(HFeO4-);
(2)向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42-+H2O.
| A. | 侯氏制碱法的主要原料是NaCl、CO2和NH3 | |
| B. | Na2CO3的热稳定性低于NaHCO3 | |
| C. | 该方法的副产物是NH4Cl | |
| D. | 母液可循环利用 |
| 族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 2 | ④ | ⑦ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑥ | ⑧ | ⑨ | ⑩ |
(2)元素①②③最高价氧化物对应的水化物中呈两性的物质的名称是氢氧化铝.
写出实验室制取该物质,反应的离子方程式为:Al3++3NH3.H2O=Al(OH)3+3NH4+.
(3)在检验某溶液是否含有①元素时,常用焰色反应.
(4)④和⑦形成化合物的化学键为:共价键.
(5)元素⑥.⑨最高价氧化物的化学式分别为:P2O5、Cl2O7.