题目内容
1.下列有机物的命名及名称书写均正确的是( )| A. | CH2BrCH2Br 二溴乙烷 | B. | CH3OOCCH3 乙酸甲酯 | ||
| C. |  硬酯酸甘油脂 硬酯酸甘油脂 | D. | 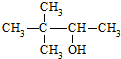 2,2二甲基-3-丁醇 2,2二甲基-3-丁醇 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.卤代烃需要标注官能团的位置,CH2BrCH2Br 1,2-二溴乙烷,故A错误;
B.酯命名是根据生成酯的酸和醇来命名为某酸某酯,此有机物是由甲醇和乙酸酯化得到的,故为乙酸甲酯,故B正确;
C.硬酯酸甘油脂是硬脂酸和甘油发生酯化反应生成的酯, 不是硬脂酸甘油酯,名称正不确,故C错误;
不是硬脂酸甘油酯,名称正不确,故C错误;
D. 编号从距离-OH最近的一端开始,-OH在2号C,在3号C与有2个甲基,名称为3,3-二甲基-2-丁醇,故D错误;
编号从距离-OH最近的一端开始,-OH在2号C,在3号C与有2个甲基,名称为3,3-二甲基-2-丁醇,故D错误;
故选B.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9. 铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:
铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$;Q>0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.006mol/(L•min);
(3)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2. K2FeO4在处理水的过程中所起的作用有杀菌消毒、净水(吸附悬浮物);
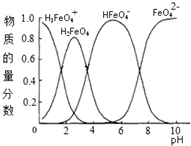
(4)高铁酸钾水溶液中FeO42-的存在形态及它们的物质的量分数随pH的变化如图所示:
(1)pH=2时溶液存在如下等量关系:c(K+)=2c(H2FeO4)+2c(H3FeO4+)+2c(HFeO4-);
(2)向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42-+H2O.
 铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:
铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是该反应在不同温度下的平衡常数:| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.006mol/(L•min);
(3)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2. K2FeO4在处理水的过程中所起的作用有杀菌消毒、净水(吸附悬浮物);
(4)高铁酸钾水溶液中FeO42-的存在形态及它们的物质的量分数随pH的变化如图所示:
(1)pH=2时溶液存在如下等量关系:c(K+)=2c(H2FeO4)+2c(H3FeO4+)+2c(HFeO4-);
(2)向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42-+H2O.
16.侯氏制碱法是将CO2通入含NH3的饱和NaCl溶液中,结晶,析出NaHCO3,过滤,将NaHCO3加热分解制得Na2CO3.母液加入NaCl,通入NH3,降温,结晶析出NH4Cl,使母液又成为含NH3的饱和NaCl溶液.下列说法错误的是( )
| A. | 侯氏制碱法的主要原料是NaCl、CO2和NH3 | |
| B. | Na2CO3的热稳定性低于NaHCO3 | |
| C. | 该方法的副产物是NH4Cl | |
| D. | 母液可循环利用 |
13.如表为元素周期表中的一部分,表中列出10种元素在周期表中的位置,按要求回答下列各题.
(1)这10种元素中,形成化合物种类最多的元素是碳(写元素名称).
(2)元素①②③最高价氧化物对应的水化物中呈两性的物质的名称是氢氧化铝.
写出实验室制取该物质,反应的离子方程式为:Al3++3NH3.H2O=Al(OH)3+3NH4+.
(3)在检验某溶液是否含有①元素时,常用焰色反应.
(4)④和⑦形成化合物的化学键为:共价键.
(5)元素⑥.⑨最高价氧化物的化学式分别为:P2O5、Cl2O7.
| 族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 2 | ④ | ⑦ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑥ | ⑧ | ⑨ | ⑩ |
(2)元素①②③最高价氧化物对应的水化物中呈两性的物质的名称是氢氧化铝.
写出实验室制取该物质,反应的离子方程式为:Al3++3NH3.H2O=Al(OH)3+3NH4+.
(3)在检验某溶液是否含有①元素时,常用焰色反应.
(4)④和⑦形成化合物的化学键为:共价键.
(5)元素⑥.⑨最高价氧化物的化学式分别为:P2O5、Cl2O7.
10.下列指定反应的离子方程式正确的是( )
| A. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 在酸性条件下,用H2O2将I-氧化为I2:H2O2+2I-+2H+=I2+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | NaHCO3溶液中加入少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
11.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3- | |
| B. | pH=1的溶液中:Fe2+、NO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol/L的溶液中:Ca2+、Cl-、HCO3- | |
| D. | c (Fe3+)=0.1mol/L的溶液中:K+、SO42-、SCN- |
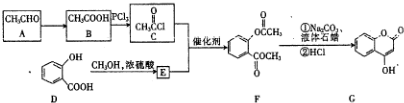
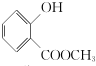 ,G中所含官能团的名称为酯基、碳碳双键、羟基;
,G中所含官能团的名称为酯基、碳碳双键、羟基;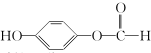 .
.