��Ŀ����
5�����������к���H��He��S��Cl��Si��Na��Mg�ȶ���Ԫ�أ�����δ������Դ���⣮��1��Siλ��Ԫ�����ڱ���������IV�壻3Heԭ�Ӻ��ڵ�������Ϊ1��
��2���á�����������գ�
| ���Ӱ뾶 | ��һ������ | �۵� | ���� |
| O2-��Na+ | Si��S | NaCl��NaF | HClO4��H2SO4 |
��4��ClO2������ˮ�ľ�������ҵ�Ͽ���Cl2����NaClO2��Һ��ȡ��д���÷�Ӧ�����ӷ���ʽ2ClO2-+Cl2=2ClO2+2Cl-��
���� ��1��Si�ĺ˵������14���������14�����ӡ�������14�����ӣ�������3�����Ӳ㡢�������4�����ӣ�����Ԫ��ԭ�Ӻ�����Ӳ���������������ȡ�����������������������ȣ�3He����2�����ӡ���������3��������=������-��������
��2�����Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С��
ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA���һ�����ܴ���������Ԫ�أ�
���Ӿ����۷е����侧���ܳ����ȣ�������������������ɳ����ȡ������Ӱ뾶�ɷ��ȣ�
Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ��
��3��MgO�����Ӿ��壬����������ԭ�Ӿ��壻
��4��Cl2��NaClO2����������ԭ����ClO2��NaCl��
��� �⣺��1��Si�ĺ˵������14���������14�����ӡ�������14�����ӣ�������3�����Ӳ㡢�������4�����ӣ�����Ԫ��ԭ�Ӻ�����Ӳ���������������ȡ�����������������������ȣ�����Siλ�ڵ������ڵ�IVA�壻3He����2�����ӡ���������3��������=������-������=3-2=1��
�ʴ�Ϊ������IVA��1��
��2�����Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С�������Ӻ������Ӻ�����Ӳ�ṹ��ͬ����ԭ������O��Na���������Ӱ뾶 O2-��Na+��
ͬһ����Ԫ�أ�Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA���һ�����ܴ���������Ԫ�أ����Ե�һ������Si��S��
���Ӿ����۷е����侧���ܳ����ȣ�������������������ɳ����ȡ������Ӱ뾶�ɷ��ȣ������Ӱ뾶С�������ӣ������۵� NaCl��NaF��
Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ���ǽ�����Cl��S����������HClO4��H2SO4��
�ʴ�Ϊ������������������
��3��MgO�Ĺ��������������ӡ���������Ĺ�������ԭ�ӣ�����MgO�����Ӿ��壬����������ԭ�Ӿ��壬�ʴ�Ϊ�����Ӿ��壻ԭ�Ӿ��壻
��4��Cl2��NaClO2����������ԭ����ClO2��NaCl�����ӷ���ʽΪ2ClO2-+Cl2=2ClO2+2Cl-���ʴ�Ϊ��2ClO2-+Cl2=2ClO2+2Cl-��
���� ���⿼�����ʽṹ�������ϵ��Ӧ�ã�Ϊ��Ƶ���㣬�漰������ԭ��Ӧ�����������жϡ�Ԫ�������ɵ�֪ʶ�㣬���ؿ���ѧ�������жϼ�֪ʶ�ۺ�������������ȷԭ�ӽṹ�����ʽṹ��Ԫ�����ڱ��ṹ��Ԫ���������ǽⱾ��ؼ����ѵ���֪ʶ��������ã���Ŀ�ѶȲ���

| A�� | Ag2S | B�� | HgS | C�� | HgCl2 | D�� | AgCl |
| A�� | ������ | B�� | �廯�� | C�� | ������� | D�� | �⻯�� |
| A�� | �����Ƽ����Ҫԭ����NaCl��CO2��NH3 | |
| B�� | Na2CO3�����ȶ��Ե���NaHCO3 | |
| C�� | �÷����ĸ�������NH4Cl | |
| D�� | ĸҺ��ѭ������ |

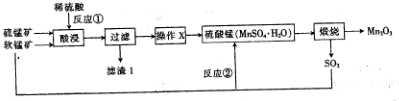
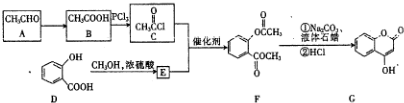
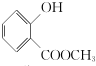 ��G�����������ŵ�����Ϊ������̼̼˫�����ǻ���
��G�����������ŵ�����Ϊ������̼̼˫�����ǻ���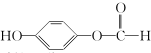 ��
��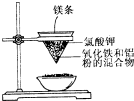 ����ͼ��ʾ��װ�ý���ʵ�飬�ش��������⣺
����ͼ��ʾ��װ�ý���ʵ�飬�ش��������⣺