题目内容
长期存放的Na2SO3可能部分被氧化.某化学兴趣小组为了测定某无水Na2SO3被氧化的程度,进行如下实验:
(1)甲同学设计如图实验流程;
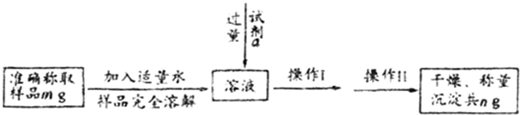
①甲同学选择的试剂a可以是 (填序号).
A.盐酸酸化后的氯化钡 B.硝酸酸化后的氯化钡 C.氢氧化钡
②判断试剂a是否过量的方法是 .
③操作Ⅱ名称是 .
④Na2SO3的质量分数的表达式为 .
(2)乙同学准确称量Na2SO3样品mg,并设计如图所示的实验装置,进行相关实验:
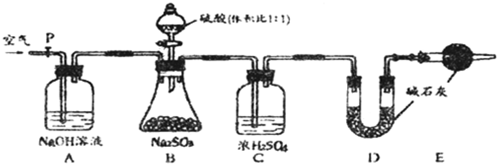
①实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 .
②装置B中发生反应的离子方程式为 .
③装置C的作用是 .
④若实验前后装置D的质量蔗为ng,则样品中Na2SO3的质量分数的表达式为 .
(1)甲同学设计如图实验流程;

①甲同学选择的试剂a可以是
A.盐酸酸化后的氯化钡 B.硝酸酸化后的氯化钡 C.氢氧化钡
②判断试剂a是否过量的方法是
③操作Ⅱ名称是
④Na2SO3的质量分数的表达式为
(2)乙同学准确称量Na2SO3样品mg,并设计如图所示的实验装置,进行相关实验:

①实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是
②装置B中发生反应的离子方程式为
③装置C的作用是
④若实验前后装置D的质量蔗为ng,则样品中Na2SO3的质量分数的表达式为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)长期存放的Na2SO3可能部分被氧化,样品中可能含有Na2SO4,加入水溶解,加入过量试剂a为盐酸酸化的氯化钡溶液,反应得到硫酸钡沉淀,过量洗涤干燥得到ng为硫酸钡沉淀;证明加入的氯化钡溶液过量的方法是利用沉淀后的上层清液中继续加入盐酸酸化的氯化钡溶液根据是否生成沉淀判断;结合元素守恒计算Na2SO3的质量分数;
(2)长期存放的Na2SO3可能部分被氧化为硫酸钠,利用和过量酸反应后加入氯化钡溶液生成沉淀证明被氧化;
①打开活塞P 从导管左端缓缓鼓入一定量的空气,这样做的目的把生成的二氧化硫全部赶入D装置吸收;
②装置B中发生反应为亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水;
③装置C是浓硫酸,用来干燥气体吸收水蒸气,D为碱石灰吸收生成的二氧化硫;
④若实验前后装置D 的质量差为ng,增大的质量为二氧化硫质量,依据元素守恒计算亚硫酸钠质量得到质量分数.
(2)长期存放的Na2SO3可能部分被氧化为硫酸钠,利用和过量酸反应后加入氯化钡溶液生成沉淀证明被氧化;
①打开活塞P 从导管左端缓缓鼓入一定量的空气,这样做的目的把生成的二氧化硫全部赶入D装置吸收;
②装置B中发生反应为亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水;
③装置C是浓硫酸,用来干燥气体吸收水蒸气,D为碱石灰吸收生成的二氧化硫;
④若实验前后装置D 的质量差为ng,增大的质量为二氧化硫质量,依据元素守恒计算亚硫酸钠质量得到质量分数.
解答:
解:(1)长期存放的Na2SO3可能部分被氧化,样品中可能含有Na2SO4,加入水溶解,加入过量试剂a为盐酸酸化的氯化钡溶液,反应得到硫酸钡沉淀,过量洗涤干燥得到ng为硫酸钡沉淀;证明加入的氯化钡溶液过量的方法是利用沉淀后的上层清液中继续加入盐酸酸化的氯化钡溶液根据是否生成沉淀判断;结合元素守恒计算Na2SO3的质量分数;
①甲同学选择的试剂a是元素酸化的氯化钡溶液,避免亚硫酸根离子沉淀,最后得到硫酸钡沉淀,硝酸酸化后的氯化钡会氧化亚硫酸钠为硫酸钠,不能测定亚硫酸钠的含量,加入氢氧化钡和亚硫酸钠、硫酸钠都会生成白色沉淀,故选A;
故答案为:A;
②证明加入的氯化钡溶液过量的方法是利用沉淀后的上层清液中继续加入盐酸酸化的氯化钡溶液根据是否生成沉淀,向上层清液中继续加入盐酸酸化的氯化钡溶液,若无白色沉淀生成证明氯化钡过量,
故答案为:向上层清液中继续加入盐酸酸化的氯化钡溶液,若无白色沉淀生成证明氯化钡过量;
③操作Ⅱ是沉淀洗涤,故答案为:洗涤;
④长期存放的Na2SO3可能部分被氧化,样品中可能含有Na2SO4,加入水溶解,加入过量试剂a为盐酸酸化的氯化钡溶液,反应得到硫酸钡沉淀,过量洗涤干燥得到ng为硫酸钡沉淀,Na2SO3的质量分数的表达式=
×100%,故答案为:
×100%;
(2)长期存放的Na2SO3可能部分被氧化为硫酸钠,利用和过量酸反应后加入氯化钡溶液生成沉淀证明被氧化,取少量样品放入洁净的试管中,加稀盐酸溶解后,继续加盐酸至溶液呈酸性,加入氯化钡溶液,若有沉淀生成则说明亚硫酸钠已被氧化;若没有沉淀生成,则说明要硫酸钠没有被氧化,
故答案为:取少量样品放入洁净的试管中,加稀盐酸溶解后,继续加盐酸至溶液呈酸性,加入氯化钡溶液,若有沉淀生成则说明亚硫酸钠已被氧化;若没有沉淀生成,则说明要硫酸钠没有被氧化;
①实验中待锥形瓶中不再产生气体后,打开活塞P 从导管左端缓缓鼓入一定量的空气,这样做的目的是使生成SO2全部进入D 中,保证实验的准确性;
故答案为:使生成SO2全部进入D 中,完全吸收保证实验的准确性;
②装置B中发生反应的离子方程式为:亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,反应的离子方程式为SO32-+2H+=SO2↑+H2O,
故答案为:SO32-+2H+=SO2↑+H2O;
③样品加入稀硫酸反应生成气体,装置C是浓硫酸,用来干燥气体吸收水蒸气,D为碱石灰吸收生成的二氧化硫,故答案为:除去二氧化硫气体中的水蒸气;
④若实验前后装置D 的质量差为ng,二氧化硫质量为ng,物质的量=
,依据硫元素守恒计算得到样品中Na2SO3的质量分数的表达式为=
×100%=
×100%,故答案为:
×100%.
①甲同学选择的试剂a是元素酸化的氯化钡溶液,避免亚硫酸根离子沉淀,最后得到硫酸钡沉淀,硝酸酸化后的氯化钡会氧化亚硫酸钠为硫酸钠,不能测定亚硫酸钠的含量,加入氢氧化钡和亚硫酸钠、硫酸钠都会生成白色沉淀,故选A;
故答案为:A;
②证明加入的氯化钡溶液过量的方法是利用沉淀后的上层清液中继续加入盐酸酸化的氯化钡溶液根据是否生成沉淀,向上层清液中继续加入盐酸酸化的氯化钡溶液,若无白色沉淀生成证明氯化钡过量,
故答案为:向上层清液中继续加入盐酸酸化的氯化钡溶液,若无白色沉淀生成证明氯化钡过量;
③操作Ⅱ是沉淀洗涤,故答案为:洗涤;
④长期存放的Na2SO3可能部分被氧化,样品中可能含有Na2SO4,加入水溶解,加入过量试剂a为盐酸酸化的氯化钡溶液,反应得到硫酸钡沉淀,过量洗涤干燥得到ng为硫酸钡沉淀,Na2SO3的质量分数的表达式=
m-
| ||
| m |
m-
| ||
| m |
(2)长期存放的Na2SO3可能部分被氧化为硫酸钠,利用和过量酸反应后加入氯化钡溶液生成沉淀证明被氧化,取少量样品放入洁净的试管中,加稀盐酸溶解后,继续加盐酸至溶液呈酸性,加入氯化钡溶液,若有沉淀生成则说明亚硫酸钠已被氧化;若没有沉淀生成,则说明要硫酸钠没有被氧化,
故答案为:取少量样品放入洁净的试管中,加稀盐酸溶解后,继续加盐酸至溶液呈酸性,加入氯化钡溶液,若有沉淀生成则说明亚硫酸钠已被氧化;若没有沉淀生成,则说明要硫酸钠没有被氧化;
①实验中待锥形瓶中不再产生气体后,打开活塞P 从导管左端缓缓鼓入一定量的空气,这样做的目的是使生成SO2全部进入D 中,保证实验的准确性;
故答案为:使生成SO2全部进入D 中,完全吸收保证实验的准确性;
②装置B中发生反应的离子方程式为:亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,反应的离子方程式为SO32-+2H+=SO2↑+H2O,
故答案为:SO32-+2H+=SO2↑+H2O;
③样品加入稀硫酸反应生成气体,装置C是浓硫酸,用来干燥气体吸收水蒸气,D为碱石灰吸收生成的二氧化硫,故答案为:除去二氧化硫气体中的水蒸气;
④若实验前后装置D 的质量差为ng,二氧化硫质量为ng,物质的量=
| ng |
| 64g/mol |
| ||
| mg |
| 126n |
| 64m |
| 126n |
| 64m |
点评:本题考查了物质成分的实验设计分析,实验验证的方法应用,主要是实验基本操作,物质性质的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的是( )
| A、在标准状况下,1 mol O2与1 mol CCl4的体积相同 |
| B、1 mol Na2O2固体中含离子总数为4NA |
| C、在相同条件下,相同体积的CO、N2的混合气体与氢气的分子数、原子数都相同 |
| D、7.1gCl2与5.6gFe反应,转移的电子总数为0.3NA |
下列实验操作中,溶液里不可能有固体析出的是( )
| A、MgCl2溶液中加入一粒绿豆大小的Na |
| B、饱和Ca(OH)2溶液中加入一粒绿豆大小的Na |
| C、CuSO4溶液中加入一粒绿豆大小的Na |
| D、水中加入一粒绿豆大小的Na |
向饱和BaSO4 溶液中加水,下列叙述正确的是( )
| A、BaSO4 溶解度增大、Ksp不变 |
| B、BaSO4 溶解度、Ksp均增大 |
| C、BaSO4 溶解度不变、Ksp增大 |
| D、BaSO4 溶解度、Ksp均不变 |
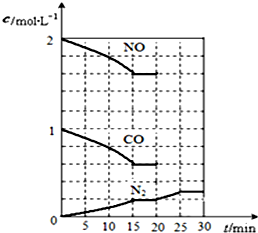 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.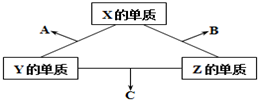 有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:
有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题: