题目内容
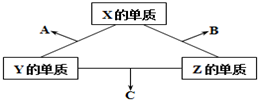 有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:
有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:(1)X元素在周期表中的位置是
(2)用X的单质与Z的单质可制成新型的化学电源(KOH溶液做电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入
(3)C与X的单质反应生成A的化学方程式为
(4)X、Y、Z三种元素可组成一种强酸W,C与W完全反应生成一种盐.该盐的水溶液pH
(5)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0.将3mol Y单质、5mol Z单质充入体积为2L的密闭容器中,平衡后C的浓度为1mol?L-1.下列说法中正确的是
a.Y单质、Z单质与C三者化学反应速率之比为1:3:2时,达到化学平衡
b.达到化学平衡时,Y、Z的物质的量之比为1:1
c.该反应的化学平衡常数为1L2?mol-2
d.达到化学平衡后,再升高温度,C的体积分数增大
(6)已知:
①Y2(g)+2X2(g)═2YX2(g);△H=+67.7kJ?mol-1.
②Y2Z4(g)+X2(g)═Y2(g)+2Z2X (g);△H=-534kJ?mol-1.
则2Y2Z4(g)+2YX2(g)═3Y2(g)+4Z2X (g)△H=
考点:无机物的推断,位置结构性质的相互关系应用,用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理,化学平衡的计算
专题:化学反应中的能量变化,元素周期律与元素周期表专题,化学平衡专题,电化学专题
分析:短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),三元素的质子数之和为16,三种单质相互化合可以得到NO、H2O、NH3,且一个B分子中含有的Z原子个数比C分子中少1个,则B为H2O、C为NH3、Z为氢,由转化关系可知,故A为NO,X为氧,Y为氮,以此解答该题.
解答:
解:短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),三元素的质子数之和为16,三种单质相互化合可以得到NO、H2O、NH3,且一个B分子中含有的Z原子个数比C分子中少1个,则B为H2O、C为NH3、Z为氢,由转化关系可知,故A为NO,X为氧,Y为氮,
(1)O元素的质子数为8,氧原子有2个电子层,最外层电子数为6,位于第2周期VIA族,故答案为:第2周期ⅥA族;
(2)X的单质与Z的单质可制成新型的化学电源,是氢氧燃料电池,正极通入氧气,发生还原反应,氢气在负极放电,碱性条件下生成水,负极电极反应式为:H2+2OH--2e-=2H2O,
故答案为:氧气;H2+2OH--2e-=2H2O;
(3)C为NH3在一定条件下反应生成A为NO,是氨气的催化氧化,反应方程式为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(4)X、Y、Z三种元素可组成一种强酸W,C与W完全反应生成一种盐,应为硝酸铵,为强酸弱碱盐,发生 NH4++H2O?NH3?H2O+H+,水解呈酸性,
故答案为:<; NH4++H2O?NH3?H2O+H+;
(5)已知氢气的单质与氮气的单质生成氨气的反应是可逆反应,△H<0.将3mol 氮气单质、5mol 氢气单质充入体积为2L的密闭容器中,平衡后氨气的浓度为1mol?L-1.
则 N2+3H2
2NH3,
起始(mol/L) 1.5 2.5 0
转化(mol/L) 0.5 1.5 1
平衡(mol/L) 1 1 1
a.无论是否达到平衡状态,Y单质、Z单质与C三者化学反应速率之比为1:3:2,不能确定是否达到化学平衡,故错误;
b.由以上分析可知达到化学平衡时,Y、Z的物质的量之比为1:1,故正确;
c.该反应的化学平衡常数为=
=1L2?mol-2,故正确;
d.正反应放热,则达到化学平衡后,再升高温度,平衡逆向移动,C的体积分数减小,故错误;
故答案为:bc;
(6)X为O元素,Y为N元素,Z为H元素,则
①N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ?mol-1.
②NH4(g)+O2(g)═N2(g)+2H2O (g);△H=-534kJ?mol-1.
由盖斯定律可知,将②×2-①可得2N2H4(g)+2NO2(g)═3N2(g)+4H2O (g)△H=(-534kJ?mol-1)×2-(+67.7kJ?mol-1)=-1135.7kJ?mol-1.
故答案为:-1135.7.
(1)O元素的质子数为8,氧原子有2个电子层,最外层电子数为6,位于第2周期VIA族,故答案为:第2周期ⅥA族;
(2)X的单质与Z的单质可制成新型的化学电源,是氢氧燃料电池,正极通入氧气,发生还原反应,氢气在负极放电,碱性条件下生成水,负极电极反应式为:H2+2OH--2e-=2H2O,
故答案为:氧气;H2+2OH--2e-=2H2O;
(3)C为NH3在一定条件下反应生成A为NO,是氨气的催化氧化,反应方程式为:4NH3+5O2
| ||
| 高温高压 |
| ||
| 高温高压 |
(4)X、Y、Z三种元素可组成一种强酸W,C与W完全反应生成一种盐,应为硝酸铵,为强酸弱碱盐,发生 NH4++H2O?NH3?H2O+H+,水解呈酸性,
故答案为:<; NH4++H2O?NH3?H2O+H+;
(5)已知氢气的单质与氮气的单质生成氨气的反应是可逆反应,△H<0.将3mol 氮气单质、5mol 氢气单质充入体积为2L的密闭容器中,平衡后氨气的浓度为1mol?L-1.
则 N2+3H2
| 高温高压 |
| 催化剂 |
起始(mol/L) 1.5 2.5 0
转化(mol/L) 0.5 1.5 1
平衡(mol/L) 1 1 1
a.无论是否达到平衡状态,Y单质、Z单质与C三者化学反应速率之比为1:3:2,不能确定是否达到化学平衡,故错误;
b.由以上分析可知达到化学平衡时,Y、Z的物质的量之比为1:1,故正确;
c.该反应的化学平衡常数为=
| (1mol/L)2 |
| 1mol/L×(1mol/L)3 |
d.正反应放热,则达到化学平衡后,再升高温度,平衡逆向移动,C的体积分数减小,故错误;
故答案为:bc;
(6)X为O元素,Y为N元素,Z为H元素,则
①N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ?mol-1.
②NH4(g)+O2(g)═N2(g)+2H2O (g);△H=-534kJ?mol-1.
由盖斯定律可知,将②×2-①可得2N2H4(g)+2NO2(g)═3N2(g)+4H2O (g)△H=(-534kJ?mol-1)×2-(+67.7kJ?mol-1)=-1135.7kJ?mol-1.
故答案为:-1135.7.
点评:本题无机物推断等,为高频考点,侧重于学生的分析能力和计算能力的考查,推断该题的突破口为X、Y、Z三种短周期元素的单质为无色气体,再结合信息与转化关系推断,题目难度中等.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
在100mL BaCl2和KCl的混合溶液中加入a mol Na2SO4溶液,恰好使Ba2+完全沉淀:如加入b mol AgNO3溶液,恰好使Cl-完全沉淀,则该混合溶液中K+浓度为( )
| A、0.1(2a-b)mol/L |
| B、0.1(b-2a)mol/L |
| C、10(b-2a)mol/L |
| D、10(2a-b)mol/L |
某二价阴离子R2-有36个电子,其质量数为79,则核内的中子数是( )
| A、39 | B、41 | C、43 | D、45 |
下列实验中,不能达到预期目的是( )
| A、向某未知溶液中滴加足量稀盐酸,再加几滴BaCl2溶液,检验SO42-的存在 |
| B、用100mL量筒量取20.00mL Na2CO3溶液 |
| C、不用另加任何试剂就能鉴别HCl、Na2CO3、Na2SO4 和BaCl2四种无色溶液 |
| D、用粥汤检验淀粉溶液具有丁达尔效应 |
 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.