题目内容
有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,其中A、C元素的原子最外层电子数相同,且A、C可形成离子化合物,B、F同主族,且C、D、F最高价氧化物的水化物能两两相互反应生成盐和水,F的最外层电子数比C多6,E元素在地壳中的含量仅次于氧,请用化学用语回答下列问题:
(1)写出A、C两种元素组成的化合物的电子式: ;
(2)B、F的氢化物沸点较高的为 :
(3)C、D与氧元素形成的常见化合物的水溶液呈碱性,其原因是 (用离子方程式表示).
(4)C、D、B按质量比为23:9:38组成一种化合物,化合物中含有的化学键类型有 .
(5)E可与氧元素通过共价键形成原子晶体,其晶胞可看作是在晶体E的晶胞中插入了 个氧原子.
(1)写出A、C两种元素组成的化合物的电子式:
(2)B、F的氢化物沸点较高的为
(3)C、D与氧元素形成的常见化合物的水溶液呈碱性,其原因是
(4)C、D、B按质量比为23:9:38组成一种化合物,化合物中含有的化学键类型有
(5)E可与氧元素通过共价键形成原子晶体,其晶胞可看作是在晶体E的晶胞中插入了
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F为原子序数依次增大的六种短周期元素,E元素在地壳中的含量仅次于氧,则E为Si元素,C、D、F最高价氧化物的水化物能两两相互反应生成盐和水,F的最外层电子数比C多6,则C为Na,D为Al,F为Cl元素;B、F同主族,则B为F;A、C元素的原子最外层电子数相同,且A、C可形成离子化合物,则A为H元素.
然后结合元素化合物知识及化学用语来解答.
然后结合元素化合物知识及化学用语来解答.
解答:
解:A、B、C、D、E、F为原子序数依次增大的六种短周期元素,E元素在地壳中的含量仅次于氧,则E为Si元素,C、D、F最高价氧化物的水化物能两两相互反应生成盐和水,F的最外层电子数比C多6,则C为Na,D为Al,F为Cl元素;B、F同主族,则B为F元素;A、C元素的原子最外层电子数相同,且A、C可形成离子化合物,则A为H元素.
(1)A为氢元素,C为钠元素,二者形成氢化钠,NaH由钠离子与氢负离子构成,电子式为 ,故答案为:
,故答案为: ;
;
(2)B、F的氢化物分别为HCl、HF,由于HF分之间能形成氢键,故HF的沸点高于HCl,故答案为:HF;
(3)C为Na,D为Al,与O形成NaAlO2,偏铝酸钠水解显碱性,水解离子方程式为:AlO2-+2H2O?Al(OH)3+OH-,故答案为:AlO2-+2H2O?Al(OH)3+OH-;
(4)C、D、B按质量比为23:9:38组成一种化合物中Na、Al、F的个数比为:
:
:
=3:1:6,化学式为:Na3AlF6,Na3AlF6中钠离子和AlF63-离子之间存在离子键,铝原子和氟原子之间存在极性键和配位键,故答案为:离子键、共价键(配位键);
(5)Si和O形成的为二氧化硅,为原子晶体,晶胞模型如图,从图中可看出,含16个氧原子,如图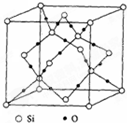 ,故答案为:16.
,故答案为:16.
(1)A为氢元素,C为钠元素,二者形成氢化钠,NaH由钠离子与氢负离子构成,电子式为
 ,故答案为:
,故答案为: ;
;(2)B、F的氢化物分别为HCl、HF,由于HF分之间能形成氢键,故HF的沸点高于HCl,故答案为:HF;
(3)C为Na,D为Al,与O形成NaAlO2,偏铝酸钠水解显碱性,水解离子方程式为:AlO2-+2H2O?Al(OH)3+OH-,故答案为:AlO2-+2H2O?Al(OH)3+OH-;
(4)C、D、B按质量比为23:9:38组成一种化合物中Na、Al、F的个数比为:
| 23 |
| 23 |
| 9 |
| 27 |
| 38 |
| 19 |
(5)Si和O形成的为二氧化硅,为原子晶体,晶胞模型如图,从图中可看出,含16个氧原子,如图
 ,故答案为:16.
,故答案为:16.
点评:本题考查无机物的推断及结构与位置关系,题目难度中等,是对知识综合运用与学生能力考查,推断元素是关键,较好的体现学生充分利用信息,对知识全面掌握的情况.

练习册系列答案
相关题目
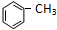 +Cl2
+Cl2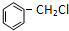 +HCl ②R-CH2-CH=CH2+Cl2
+HCl ②R-CH2-CH=CH2+Cl2
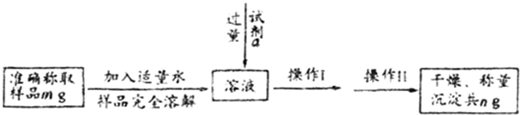
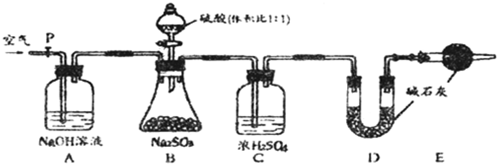
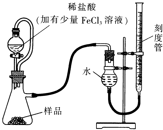 镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.
镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.