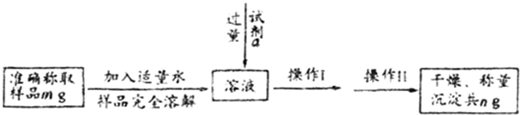
题目内容
设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的是( )
| A、在标准状况下,1 mol O2与1 mol CCl4的体积相同 |
| B、1 mol Na2O2固体中含离子总数为4NA |
| C、在相同条件下,相同体积的CO、N2的混合气体与氢气的分子数、原子数都相同 |
| D、7.1gCl2与5.6gFe反应,转移的电子总数为0.3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标况下,四氯化碳为液态;
B、Na2O2由O22-和Na+构成;
C、根据阿伏伽德罗定律来分析;
D、根据铁和氯气的物质的量结合化学方程式来解题.
B、Na2O2由O22-和Na+构成;
C、根据阿伏伽德罗定律来分析;
D、根据铁和氯气的物质的量结合化学方程式来解题.
解答:
解:A、标况下,四氯化碳为液态,故A错误;
B、Na2O2由O22-和Na+构成,故1molNa2O2含1molO22-和2molNa+,即由3mol离子构成,故B错误;
C、根据阿伏伽德罗定律可知,同温同压下相同体积的CO、N2的混合气体与氢气的物质的量相同,故分子数相同,而CO、N2与氢气均为双原子分子,故原子数也相同,故C正确;
D、5.6g铁的物质的量为0.1mol,7.1g氯气的物质的量也为0.1mol,由反应可知,铁过量,0.1mol氯气完全反应变为-1价,故转移0.2mol电子,故D错误.
故选C.
B、Na2O2由O22-和Na+构成,故1molNa2O2含1molO22-和2molNa+,即由3mol离子构成,故B错误;
C、根据阿伏伽德罗定律可知,同温同压下相同体积的CO、N2的混合气体与氢气的物质的量相同,故分子数相同,而CO、N2与氢气均为双原子分子,故原子数也相同,故C正确;
D、5.6g铁的物质的量为0.1mol,7.1g氯气的物质的量也为0.1mol,由反应可知,铁过量,0.1mol氯气完全反应变为-1价,故转移0.2mol电子,故D错误.
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
化学无处不在,下列与化学有关的说法不正确的是( )
| A、可用蘸浓硫酸的棉花棒检验输送氨气的管道是否漏气 |
| B、“地沟油”禁止食用,但可用来制肥皂 |
| C、从海水中提取物质都必须经过化学反应才能实现 |
| D、侯式制碱法的工艺过程中应用了物质溶液度的差异 |
 硼化钒(VB2)-空气电池能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )
硼化钒(VB2)-空气电池能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2+11O2→4B2O3+2V2O5.下列说法正确的是( )| A、电极a为电池负极 |
| B、图中选择性透过膜只能让阳离子选择性透过 |
| C、电子由VB2极经KOH溶液流向a电极 |
| D、VB2极发生的电极反应为:2VB2+22OH--22e-→V2O5+2B2O3+11H2O |
下列溶液中Cl-的物质的量浓度最大的是( )
| A、200 mL 2 mol?L-1 MgCl2溶液 |
| B、1000 mL 2.5 mol?L-1 NaCl溶液 |
| C、250 mL 1 mol?L-1 AlCl3溶液 |
| D、300 mL 5 mol?L-1 KClO3溶液 |
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA | ||
B、标准状况下,2.24L氯气中含有的
| ||
| C、常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | ||
| D、80mL 10mol?L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA |
下列离子方程式正确的是( )
| A、醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B、碘水中通入足量的SO2:I2+SO2+2H2O=2HI+SO42-+2H+ |
| C、NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D、4 mol?L-1的NaAlO2溶液和7 mol?L-1的盐酸溶液等体积混合均匀4AlO2-+7H++H2O=3A1(OH)3↓+Al3+ |
在100mL BaCl2和KCl的混合溶液中加入a mol Na2SO4溶液,恰好使Ba2+完全沉淀:如加入b mol AgNO3溶液,恰好使Cl-完全沉淀,则该混合溶液中K+浓度为( )
| A、0.1(2a-b)mol/L |
| B、0.1(b-2a)mol/L |
| C、10(b-2a)mol/L |
| D、10(2a-b)mol/L |