题目内容
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.(1)处理NOx的一种方法是利用甲烷催化还原NOx.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0.该反应的化学平衡常数表达式为K=
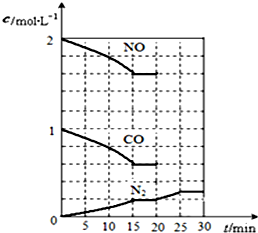
若在一定温度下,将 2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如右图所示.若改变反应条件,导致N2浓度发生如图所示 的变化,则改变的条件可能是
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)依据已知的热化学方程式利用盖斯定律解答;
(2)化学平衡常数K=
;氮气浓度缓慢增大,说明平衡正向移动且改变条件的瞬间氮气浓度没有变化.
(2)化学平衡常数K=
| 生成物浓度系数幂次方 |
| 反应物浓度系数幂次方 |
解答:
解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
由盖斯定律(①+②)÷2得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1;
(2)反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0,该反应的平衡常数表达式K=
,
①加入催化剂,平衡不移动,故不选;
②降低温度,平衡正向移动,故选;
③缩小容器体积,氮气浓度应瞬时增大,平衡再正向移动,故不选;
④增加CO2的量,平衡逆向,故不选;
故答案为:
;②.
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
由盖斯定律(①+②)÷2得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1;
(2)反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0,该反应的平衡常数表达式K=
| [N2]?[CO2]2 |
| [CO]2?[NO]2 |
①加入催化剂,平衡不移动,故不选;
②降低温度,平衡正向移动,故选;
③缩小容器体积,氮气浓度应瞬时增大,平衡再正向移动,故不选;
④增加CO2的量,平衡逆向,故不选;
故答案为:
| [N2]?[CO2]2 |
| [CO]2?[NO]2 |
点评:本题考查了盖斯定律的应用、平衡常数表达式的书写、平衡移动及图象分析,是一道综合考查题,难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA | ||
B、标准状况下,2.24L氯气中含有的
| ||
| C、常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | ||
| D、80mL 10mol?L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA |
有8g Na2O2、Na2O、Na2CO3、NaOH的固体混合物,与400g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为( )
| A、16g | B、23.4g |
| C、31g | D、无法计算 |
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.