题目内容
 有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.
有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.请回答下列问题:
(1)基态Z原子的核外电子排布式是
(2)某化合物由E、Y两种元素组成,其晶胞如图,该化合物的化学式为
(3)在化合物Y2ZE4的水溶液入适量硫酸,能观察到的现象是
(4)A的简单氢化物极易溶于E的简单氢化物,其原因是
(5)A的最高价氧化物对应水化物的稀溶液与R的单质反应时,A被还原到最低价,该反应的化学方程式是
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题
分析:A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,则A是N元素;
原子的第一电离能E<A,E的元素序数大于A,而第一电离能小于A,则E是O元素;
R是地壳中含量最高的金属元素,则R是Al元素;
X原子核外的M层中有三对成对电子,则X是Cl元素;
Y为周期表前四周期中电负性最小的元素,则Y是K元素;
Z原子核外电子数为24,则Z是Cr元素;
再结合物质结构、性质解答.
原子的第一电离能E<A,E的元素序数大于A,而第一电离能小于A,则E是O元素;
R是地壳中含量最高的金属元素,则R是Al元素;
X原子核外的M层中有三对成对电子,则X是Cl元素;
Y为周期表前四周期中电负性最小的元素,则Y是K元素;
Z原子核外电子数为24,则Z是Cr元素;
再结合物质结构、性质解答.
解答:
解:A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,则A是N元素;
原子的第一电离能E<A,E的元素序数大于A,而第一电离能小于A,则E是O元素;
R是地壳中含量最高的金属元素,则R是Al元素;
X原子核外的M层中有三对成对电子,则X是Cl元素;
Y为周期表前四周期中电负性最小的元素,则Y是K元素;
Z原子核外电子数为24,则Z是Cr元素;
(1)Z是Cr元素,其原子核外有24个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d54s1或[Ar])3d54s1,NO2+与二氧化碳分子互为等电子体,其结构相似,所以NO2+的电子式是 ,NCl3分子中N原子价层电子对个数=3+
,NCl3分子中N原子价层电子对个数=3+
(5-3×1)=4,所以NCl3的VSEPR模型是正四面体,
故答案为:1s22s22p63s23p63d54s1或[Ar])3d54s1; ;正四面体;
;正四面体;
(2)某化合物由O、K两种元素组成,该晶胞中钾离子个数=8×
+6×
=4,过氧根离子个数=1+12×
=4,所以钾离子和过氧根离子个数之比=4:4=1:1,所以其化学式为KO2,故答案为:KO2;
(3)在化合物K2CrO4的水溶液入适量硫酸,发生反应2K2CrO4+H2SO4?K2SO4+K2Cr2O7+H2O,Cr2O72-在水溶液中为橙色,CrO42-在水溶液中为黄色,所以溶液由黄色变成橙色,故答案为:溶液由黄色变成橙色;
(4)A的简单氢化物是NH3,E的简单氢化物是H2O,二者都是极性分子,且它们分子之间能形成氢键,氢键的存在导致它们易互溶,故答案为:NH3、H2O都是极性分子,且它们分子间还能形成氢键;
(5)A的最高价氧化物对应水化物的稀溶液是硝酸,稀硝酸和Al反应时,A被还原到最低价,则N元素被还原为硝酸铵,同时铝被氧化生成硝酸铝,所以其反应方程式为:8Al+30HNO3 =8Al(NO3)3 +3NH4NO3 +9H2O,故答案为:8Al+30HNO3 =8Al(NO3)3 +3NH4NO3 +9H2O.
原子的第一电离能E<A,E的元素序数大于A,而第一电离能小于A,则E是O元素;
R是地壳中含量最高的金属元素,则R是Al元素;
X原子核外的M层中有三对成对电子,则X是Cl元素;
Y为周期表前四周期中电负性最小的元素,则Y是K元素;
Z原子核外电子数为24,则Z是Cr元素;
(1)Z是Cr元素,其原子核外有24个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d54s1或[Ar])3d54s1,NO2+与二氧化碳分子互为等电子体,其结构相似,所以NO2+的电子式是
 ,NCl3分子中N原子价层电子对个数=3+
,NCl3分子中N原子价层电子对个数=3+| 1 |
| 2 |
故答案为:1s22s22p63s23p63d54s1或[Ar])3d54s1;
 ;正四面体;
;正四面体; (2)某化合物由O、K两种元素组成,该晶胞中钾离子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
(3)在化合物K2CrO4的水溶液入适量硫酸,发生反应2K2CrO4+H2SO4?K2SO4+K2Cr2O7+H2O,Cr2O72-在水溶液中为橙色,CrO42-在水溶液中为黄色,所以溶液由黄色变成橙色,故答案为:溶液由黄色变成橙色;
(4)A的简单氢化物是NH3,E的简单氢化物是H2O,二者都是极性分子,且它们分子之间能形成氢键,氢键的存在导致它们易互溶,故答案为:NH3、H2O都是极性分子,且它们分子间还能形成氢键;
(5)A的最高价氧化物对应水化物的稀溶液是硝酸,稀硝酸和Al反应时,A被还原到最低价,则N元素被还原为硝酸铵,同时铝被氧化生成硝酸铝,所以其反应方程式为:8Al+30HNO3 =8Al(NO3)3 +3NH4NO3 +9H2O,故答案为:8Al+30HNO3 =8Al(NO3)3 +3NH4NO3 +9H2O.
点评:本题考查了物质结构和性质的关系,熟悉原子结构是解本题关键,根据原子结构、核外电子的排布结合元素周期律来确定元素,再根据物质的性质、均摊法、等电子体、构造原理等知识点来分析解答,知道氢键对物质溶解度的影响、等电子体的结构和性质的相似性等知识点,灵活运用这些知识解答,题目难度中等.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、SO42- |
| B、加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的溶液:Al3+、Ba2+、Cl-、HCO3- |
| C、水电离产生的c(H+)=10-13mol?L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| D、0.1mol?L-1HNO3溶液中:Mg2+、NH4+、Fe2+、Cl- |
现有浓度均为0.10mo1?L-1的①Na2CO3溶液和②NaHCO3溶液.下列说法不正确的是( )
| A、①中有:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B、②中有:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| C、①和②混合溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D、①或②中都有:c(HCO3-)+c(CO32-)+c(H2CO3)=0.10 mol?L-1 |
 B.现有A、B、C、D、E、F五种有机物,它们的转化关系如下图所示(图中部分反应条件及生成物没有全部写出).已知:液体B能发生银镜反应,气体D的相对分子质量为28.
B.现有A、B、C、D、E、F五种有机物,它们的转化关系如下图所示(图中部分反应条件及生成物没有全部写出).已知:液体B能发生银镜反应,气体D的相对分子质量为28.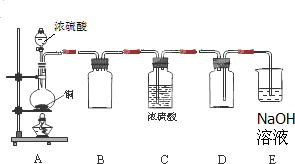 Na2SO3、SO2是中学常见的物质.
Na2SO3、SO2是中学常见的物质.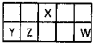 I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题: