题目内容
下表是元素周期表的一部分,请回答有关问题:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为
(2)③⑤⑦元素原子形成简单离子半径由大到小的顺序是 (填离子符号)
(3)某元素二价阳离子的核外有10个电子,该元素是 (填元素名称)
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱溶液反应的是 (填化学式).
(5)这些元素形成的单质中,可用于制造晶体管、集成电路等电子元件的是 (填元素符号);它的氧化物可与焦炭反应生成它的单质的化学方程式为 .
(6)④的单质与水反应的化学方程式是(并标出电子转移的方向与数目) .
(7)⑦元素的单质常温下的颜色是 ,并用电子式表示⑦元素的氢化物形成过程为 .
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)③⑤⑦元素原子形成简单离子半径由大到小的顺序是
(3)某元素二价阳离子的核外有10个电子,该元素是
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱溶液反应的是
(5)这些元素形成的单质中,可用于制造晶体管、集成电路等电子元件的是
(6)④的单质与水反应的化学方程式是(并标出电子转移的方向与数目)
(7)⑦元素的单质常温下的颜色是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置可知:①Be②N③F④Na⑤Al⑥Si⑦Cl⑧Ar.
(1)稀有气体的化学性质最不活泼,Ar原子质子数为18,核外电子数为18,K层2、L层8、M层8;
(2)③⑤⑦元素原子形成简单离子分别是:F-、Al3+、Cl-,电子层数越多、半径越大,电子层结构相同的离子,质子数越大半径越小;
(3)对于阳离子而言:质子数=核外电子数+所带电荷数;
(4)既能与强酸又能与强碱溶液反应的氧化物,属于两性氧化物;
(5)用于制造晶体管、集成电路等电子元件的是硅,二氧化硅与焦炭反应生成粗硅和CO;
(6)Na与水反应生成氢氧化钠和氢气,Na作还原剂,水作氧化剂,2个Na原子反应转移电子数2个;
(7)氯气常温下为黄绿色气体,氯化氢是氯原子和氢原子形成的共价化合物.
(1)稀有气体的化学性质最不活泼,Ar原子质子数为18,核外电子数为18,K层2、L层8、M层8;
(2)③⑤⑦元素原子形成简单离子分别是:F-、Al3+、Cl-,电子层数越多、半径越大,电子层结构相同的离子,质子数越大半径越小;
(3)对于阳离子而言:质子数=核外电子数+所带电荷数;
(4)既能与强酸又能与强碱溶液反应的氧化物,属于两性氧化物;
(5)用于制造晶体管、集成电路等电子元件的是硅,二氧化硅与焦炭反应生成粗硅和CO;
(6)Na与水反应生成氢氧化钠和氢气,Na作还原剂,水作氧化剂,2个Na原子反应转移电子数2个;
(7)氯气常温下为黄绿色气体,氯化氢是氯原子和氢原子形成的共价化合物.
解答:
解:(1)稀有气体的化学性质最不活泼,Ar原子质子数为18,核外电子数为18,K层2、L层8、M层8,原子结构示意图为: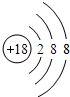 ,
,
故答案为: ;
;
(2))③⑤⑦元素原子形成简单离子分别是:F-、Al3+、Cl-,电子层数越多、半径越大,因此Cl-半径最大,电子层结构相同的离子,质子数越大半径越小,因此
离子半径:F->Al3+,所以离子半径:Cl->F->Al3+,
故答案为:Cl->F->Al3+;
(3)对于阳离子而言:质子数=核外电子数+所带电荷数,该元素的质子数=10+2=12,为镁元素,故答案为:镁;
(4)既能与强酸又能与强碱溶液反应的氧化物,属于两性氧化物,Al2O3属于两性氧化物,且不溶于水,故答案为:Al2O3;
(5)用于制造晶体管、集成电路等电子元件的是硅,二氧化硅与焦炭反应生成粗硅和CO,化学方程式为SiO2+2C
Si+2CO↑,
故答案为:Si;SiO2+2C
Si+2CO↑;
(6)Na与水反应生成氢氧化钠和氢气,Na作还原剂,水作氧化剂,2个Na原子反应转移电子数2个,化学方程式及转移电子表示为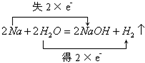 ,
,
故答案为: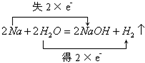 ;
;
(7)氯气常温下为黄绿色气体,氯化氢是氯原子和氢原子形成的共价化合物,形成过程表示为: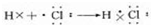 ,
,
故答案为: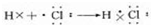 .
.
 ,
,故答案为:
 ;
;(2))③⑤⑦元素原子形成简单离子分别是:F-、Al3+、Cl-,电子层数越多、半径越大,因此Cl-半径最大,电子层结构相同的离子,质子数越大半径越小,因此
离子半径:F->Al3+,所以离子半径:Cl->F->Al3+,
故答案为:Cl->F->Al3+;
(3)对于阳离子而言:质子数=核外电子数+所带电荷数,该元素的质子数=10+2=12,为镁元素,故答案为:镁;
(4)既能与强酸又能与强碱溶液反应的氧化物,属于两性氧化物,Al2O3属于两性氧化物,且不溶于水,故答案为:Al2O3;
(5)用于制造晶体管、集成电路等电子元件的是硅,二氧化硅与焦炭反应生成粗硅和CO,化学方程式为SiO2+2C
| ||
故答案为:Si;SiO2+2C
| ||
(6)Na与水反应生成氢氧化钠和氢气,Na作还原剂,水作氧化剂,2个Na原子反应转移电子数2个,化学方程式及转移电子表示为
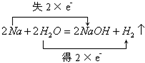 ,
,故答案为:
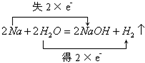 ;
;(7)氯气常温下为黄绿色气体,氯化氢是氯原子和氢原子形成的共价化合物,形成过程表示为:
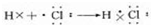 ,
,故答案为:
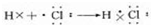 .
.
点评:本题以前18号元素为载体考查化学用语和元素周期律的知识,要充分掌握原子半径的大小比较、氧化还原反应中转移电子数的表示方法等,整体难度不大.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、将8.96L(标准状况)CO2通入100mL 3mol?L-1 NaOH溶液中:3CO2+4OH═CO32-+2HCO3-+H2O | ||||
| B、Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | ||||
C、用铁棒作阳极、炭棒作阴极电解饱和氯化钠溶液:2Cl-+2H2O
| ||||
| D、硫酸铝溶液和过量的氢氧化钡溶液混合Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
下列离子方程式书写正确的是( )
| A、将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液中Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全Ba2++OH-+H++SO42-=BaSO4↓+H2O |
C、服用阿司匹林过量出现水杨酸( )反应,可静脉注射碳酸氢钠溶液: )反应,可静脉注射碳酸氢钠溶液: |
| D、向FeI2溶液中加少量氯水 2Fe2++Cl2=2Fe3++2Cl- |

 有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.
有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.