题目内容
在3517Cl原子中含有 个质子, 个中子;它的原子结构示意图为 .铁在氯气中燃烧,生成 (填化学式),在这个反应中,氯气是 剂(填“氧化”或“还原”).在此反应中,每转移1.5mol电子,消耗的铁是 g.
考点:质量数与质子数、中子数之间的相互关系,氧化还原反应
专题:氧化还原反应专题,原子组成与结构专题
分析:根据原子符号中左下角数字为质子数,左上角数字为质量数,中子数=质量数-质子数;氯的原子序数为17,原子核外有3个电子层,最外层电子数为7;变价金属在氯气中燃烧,生成高价态的氯化物,化合价降低的反应物是氧化剂;根据氧化剂、还原剂之间得失电子数目结合反应的化学方程式计算相关物质的物质的量.
解答:
解:3517Cl原子的质子数为17,质量数为35,中子数为35-17=18,氯的原子结构示意图为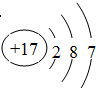 ; 铁在氯气中燃烧,生成FeCl3,氯气中氯元素的化合价降低,是氧化剂;
; 铁在氯气中燃烧,生成FeCl3,氯气中氯元素的化合价降低,是氧化剂;
2Fe+3Cl2
2FeCl3,该反应中铁元素的化合价由0价升高到+3价,则消耗了1mol铁,若反应中转移1.5mol电子,则应有0.5mol铁参加反应,即28g铁.
故答案为:17;18;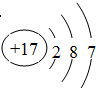 ;FeCl3;氧化;28.
;FeCl3;氧化;28.
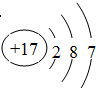 ; 铁在氯气中燃烧,生成FeCl3,氯气中氯元素的化合价降低,是氧化剂;
; 铁在氯气中燃烧,生成FeCl3,氯气中氯元素的化合价降低,是氧化剂;2Fe+3Cl2
| ||
故答案为:17;18;
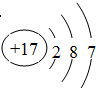 ;FeCl3;氧化;28.
;FeCl3;氧化;28.
点评:本题主要考查了原子符号的含义、物质的性质以及氧化还原反应中电子的转移,难度不大,注意对应知识的积累.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、酸性FeSO4溶液中加入双氧水:2Fe2++H2O2+2H+═2Fe3++2H2O | ||||
B、电解饱和MgCl2溶液:2H2O+2Cl-
| ||||
| C、向Ca(ClO)2溶液中通入SO2气体:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO | ||||
| D、向饱和碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
某新型药物的结构简式如图所示,下列关于该化合物的说法错误的是( )


| A、既能发生加成反应又能发生取代反应 |
| B、在溶液中该分子的羟基可以电离出H+ |
| C、该分子中含有两种官能团 |
| D、该分子中所有碳原于不可能完全共平面 |
设NA为阿伏加罗常数的值,下列说法正确的是( )
| A、足量Fe在1mol Cl2中充分燃烧,转移3NA个电子 |
| B、7.8g Na2O2中阴、阳离子总数为0.3NA |
| C、电解精炼铜时,若转移NA个电子,则阳极减少的质量为32g |
| D、反应KClO3+6HCl═KCl+3Cl2↑+3H2O中,若有1 mol H2O生成,转移电子数为2NA |
 有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.
有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.