��Ŀ����
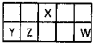 I��������Ԫ��X��Y��Z��W��Ԫ�����ڱ������λ����ͼ��ʾ������Y������������������������ȣ���Ҫ��ش��������⣺
I��������Ԫ��X��Y��Z��W��Ԫ�����ڱ������λ����ͼ��ʾ������Y������������������������ȣ���Ҫ��ش��������⣺��1��д��X��ԭ�ӽṹʾ��ͼ
��2���о�һ����ʵ˵��W�ǽ�����ǿ��Z��
��3����Y��ij���γ�������ˮ�����侻ˮԭ����
��������ѧ��ѧԭ��������������⣺
��4����֪��Si+2NaOH+H2O=Na2SiO3+2H2��ijͬѧ���õ��ʹ����Ϊ�缫�������ԭ��أ�NaOHΪ�������Һ������ԭ��ظ����ĵ缫��ӦʽΪ
��5����֪����C��s��+O2��g���TCO2��g����H=a kJ?mol-1����CO2��g��+C��s���T2CO��g����H=b kJ?mol-1����Si��s��+O2��g���TSiO2��s����H=c kJ?mol-1����ҵ�������ֹ���Ȼ�ѧ����ʽΪ
��6����֪��CO��g��+H2O��g���TH2��g��+CO2��g�������Ϊ�÷�Ӧ�ڲ�ͬ�¶�ʱ��ƽ�ⳣ������÷�Ӧ�ġ�H
| �¶�/�� | 400 | 500 | 600 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
���㣺λ�ýṹ���ʵ����ϵӦ��,�ø�˹���ɽ����йط�Ӧ�ȵļ���,��ѧƽ��ļ���
ר�⣺��ѧ��Ӧ�е������仯,Ԫ����������Ԫ�����ڱ�ר��,��ѧƽ��ר��
���������ɶ�����Ԫ��X��Y��Z��W�����ڱ������λ�ÿ�֪��X���ڵڶ����ڣ�����Ԫ�ش��ڵ������ڣ�����Y������������������������ȣ����ڢ�A�壬��YΪAl��ZΪSi��XΪN��WΪCl���ݴ˽��
��4����������������Ӧ��Si�ڸ�����ʧȥ���ӣ��������������ɹ������ˮ��
��5�����ݸ�˹������дĿ���Ȼ�ѧ����ʽ��
��6���ɱ������ݿ�֪�������¶ȣ�ƽ�ⳣ����С��ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ��
CO��H2O��ʼŨ����ȣ������ǵ�Ũ��Ϊ1mol/L����ƽ��ʱCO��Ũ�ȱ仯��Ϊxmol/L����������ʽ��ʾ��ƽ��ʱ����ֵ�Ũ�ȣ�����ƽ�ⳣ���з��̼��㣬��������COת���ʣ�
��4����������������Ӧ��Si�ڸ�����ʧȥ���ӣ��������������ɹ������ˮ��
��5�����ݸ�˹������дĿ���Ȼ�ѧ����ʽ��
��6���ɱ������ݿ�֪�������¶ȣ�ƽ�ⳣ����С��ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ��
CO��H2O��ʼŨ����ȣ������ǵ�Ũ��Ϊ1mol/L����ƽ��ʱCO��Ũ�ȱ仯��Ϊxmol/L����������ʽ��ʾ��ƽ��ʱ����ֵ�Ũ�ȣ�����ƽ�ⳣ���з��̼��㣬��������COת���ʣ�
���
�⣺���ɶ�����Ԫ��X��Y��Z��W�����ڱ������λ�ÿ�֪��X���ڵڶ����ڣ�����Ԫ�ش��ڵ������ڣ�����Y������������������������ȣ����ڢ�A�壬��YΪAl��ZΪSi��XΪN��WΪCl��
��1��XΪNԪ�أ�ԭ�ӽṹʾ��ͼΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2����ۺ����������ǿ������˵���ǽ�����ǿ��������ʽΪ2HClO4+Na2SiO3=2NaClO4+H2SiO3����
�ʴ�Ϊ��2HClO4+Na2SiO3=2NaClO4+H2SiO3����
��3����������Һ��������ˮ��õ������������壬����������ˮ������ˮԭ�����ӷ���ʽΪ��Al3+3H2O=Al��OH��3�����壩+3H+��
�ʴ�Ϊ��Al3+3H2O=Al��OH��3�����壩+3H+��
��4����������������Ӧ��Si�ڸ�����ʧȥ���ӣ��������������ɹ������ˮ�������缫��ӦʽΪ��Si+6OH--4e-=SiO32-+3H2O��
�ʴ�Ϊ��Si+6OH--4e-=SiO32-+3H2O��
��5����֪����C��s��+O2��g���TCO2��g����H=a kJ?mol-1��
��CO2��g��+C��s���T2CO��g����H=b kJ?mol-1��
��Si��s��+O2��g���TSiO2��s����H=c kJ?mol-1��
���ݸ�˹���ɣ���+��-�۵ã�2C��s��+SiO2��s��=2CO��g��+Si��s����H=��a+b-c�� kJ?mol-1��
�ʴ�Ϊ��2C��s��+SiO2��s��=2CO��g��+Si��s����H=��a+b-c�� kJ?mol-1��
��6���ɱ������ݿ�֪�������¶ȣ�ƽ�ⳣ����С��ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ������H��0��
CO��H2O��ʼŨ����ȣ������ǵ���ʼŨ��Ϊ1mol/L����ƽ��ʱCO��Ũ�ȱ仯��Ϊxmol/L����
CO��g��+H2O��g���TH2��g��+CO2��g��
��ʼ��mol/L����1 1 0 0
ת����mol/L����x x x x
ƽ�⣨mol/L����1-x 1-x x x
��
=9�����x=0.75��
��CO��ת����=
��100%=75%��
�ʴ�Ϊ������75%��
��1��XΪNԪ�أ�ԭ�ӽṹʾ��ͼΪ
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
����2����ۺ����������ǿ������˵���ǽ�����ǿ��������ʽΪ2HClO4+Na2SiO3=2NaClO4+H2SiO3����
�ʴ�Ϊ��2HClO4+Na2SiO3=2NaClO4+H2SiO3����
��3����������Һ��������ˮ��õ������������壬����������ˮ������ˮԭ�����ӷ���ʽΪ��Al3+3H2O=Al��OH��3�����壩+3H+��
�ʴ�Ϊ��Al3+3H2O=Al��OH��3�����壩+3H+��
��4����������������Ӧ��Si�ڸ�����ʧȥ���ӣ��������������ɹ������ˮ�������缫��ӦʽΪ��Si+6OH--4e-=SiO32-+3H2O��
�ʴ�Ϊ��Si+6OH--4e-=SiO32-+3H2O��
��5����֪����C��s��+O2��g���TCO2��g����H=a kJ?mol-1��
��CO2��g��+C��s���T2CO��g����H=b kJ?mol-1��
��Si��s��+O2��g���TSiO2��s����H=c kJ?mol-1��
���ݸ�˹���ɣ���+��-�۵ã�2C��s��+SiO2��s��=2CO��g��+Si��s����H=��a+b-c�� kJ?mol-1��
�ʴ�Ϊ��2C��s��+SiO2��s��=2CO��g��+Si��s����H=��a+b-c�� kJ?mol-1��
��6���ɱ������ݿ�֪�������¶ȣ�ƽ�ⳣ����С��ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ������H��0��
CO��H2O��ʼŨ����ȣ������ǵ���ʼŨ��Ϊ1mol/L����ƽ��ʱCO��Ũ�ȱ仯��Ϊxmol/L����
CO��g��+H2O��g���TH2��g��+CO2��g��
��ʼ��mol/L����1 1 0 0
ת����mol/L����x x x x
ƽ�⣨mol/L����1-x 1-x x x
��
| x?x |
| (1-x)?(1-x) |
��CO��ת����=
| 0.75mol/L |
| 1mol/L |
�ʴ�Ϊ������75%��
���������⿼��ṹ����λ�ù�ϵӦ�á�ԭ��ء��Ȼ�ѧ����ʽ����ѧƽ�����ȣ����ضԻ���֪ʶ�Ĺ��̣���4���и����缫��Ӧʽ���������ܷ�Ӧʽ��ȥ�����缫��Ӧʽ��д���ѶȲ���

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
 ��һ�ȴ��ﹲ�У�������
��һ�ȴ��ﹲ�У�������| A��3�� | B��4�� | C��5�� | D��6�� |
ij����ҩ��Ľṹ��ʽ��ͼ��ʾ�����й��ڸû������˵��������ǣ�������


| A�����ܷ����ӳɷ�Ӧ���ܷ���ȡ����Ӧ |
| B������Һ�и÷��ӵ��ǻ����Ե����H+ |
| C���÷����к������ֹ����� |
| D���÷���������̼ԭ�ڲ�������ȫ��ƽ�� |
���������в��ܸ�����Cu��OH��2��Ӧ���ǣ�������
| A��HCOOH |
| B��CH3COOH |
| C��CH3CH2OH |
| D��CH3CHO |
 ��A��E��R��X��Y��Z����ǰ������Ԫ�أ�ԭ��������������̬Aԭ�ӵ�2p����������״̬��ԭ�ӵĵ�һ������E��A��R�ǵؿ��к�����ߵĽ���Ԫ�أ�Xԭ�Ӻ����M���������ԳɶԵ��ӣ�YΪ���ڱ�ǰ�������е縺����С��Ԫ�أ�Zԭ�Ӻ��������Ϊ24��
��A��E��R��X��Y��Z����ǰ������Ԫ�أ�ԭ��������������̬Aԭ�ӵ�2p����������״̬��ԭ�ӵĵ�һ������E��A��R�ǵؿ��к�����ߵĽ���Ԫ�أ�Xԭ�Ӻ����M���������ԳɶԵ��ӣ�YΪ���ڱ�ǰ�������е縺����С��Ԫ�أ�Zԭ�Ӻ��������Ϊ24��