题目内容
 Na2SO3、SO2是中学常见的物质.
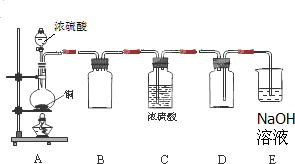
Na2SO3、SO2是中学常见的物质.(1)某同学用如图示装置制取干燥纯净的SO2.
写出制取SO2气体的化学方程式
(2)向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色.反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告.限选试剂:2mol/L HCl,1mol/L H2SO4,1mol/L BaCl2,1mol/L Ba(NO3)2,0.1mol/L AgNO3,CCl4,新制饱和溴水,新制饱和氯水.
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色. | |
| 步骤② | 在试管B中加入少量待测液, |
有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤③ | 在试管C中加入少量待测液,滴加2mol/LHCl至溶液呈酸性,加入几滴 |
证明待测液中含SO32-. |
考点:常见离子的检验方法,常见气体制备原理及装置选择
专题:实验设计题
分析:(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化碳气体和水,据此写出反应的化学方程式;二氧化硫的密度大于空气,应该使用向上排空气法收集,即导气管应该采用长进短出方式;浓硫酸具有腐蚀性,若沾到皮肤上,应该立即用大量的水冲洗,然后涂上稀的碳酸氢钠溶液;
(2)①利用萃取后,溴溶解在四氯化碳中,下层为橙红色,鉴定Br-;
②加盐酸先排除亚硫酸离子,再利用硫酸钡白色沉淀的生成鉴定SO42-;
③利用溴水与亚硫酸根离子的氧化还原反应,鉴定SO32-.
(2)①利用萃取后,溴溶解在四氯化碳中,下层为橙红色,鉴定Br-;
②加盐酸先排除亚硫酸离子,再利用硫酸钡白色沉淀的生成鉴定SO42-;
③利用溴水与亚硫酸根离子的氧化还原反应,鉴定SO32-.
解答:
(1)铜与浓硫酸反应的化学方程式为:Cu+2H2SO4 (浓)
CuSO4 +SO2↑+2H2O;收集二氧化硫,应该采用长进短出方式,图中集气瓶的进气管比出气管短,应该进气管比出气管长;若实验过程中不慎在皮肤上沾少量浓硫酸,应该立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液,
故答案为:Cu+2H2SO4 (浓)
CuSO4 +SO2↑+2H2O;进气管比出气管短;立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液;
(2)步骤①另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-;
步骤②另取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-;
步骤③加新制饱和溴水与亚硫酸根离子的氧化还原反应,观察溴水褪色,说明含SO32-,
故答案为:
| ||
故答案为:Cu+2H2SO4 (浓)
| ||
(2)步骤①另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-;
步骤②另取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-;
步骤③加新制饱和溴水与亚硫酸根离子的氧化还原反应,观察溴水褪色,说明含SO32-,
故答案为:
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 溶液分层,下层呈橙红色 | |
| 步骤② | 加入过量的2mol/L盐酸,再滴加1mol/L BaCl2溶液 | |
| 步骤③ | 新制饱和溴水 | 溴水褪色 |
点评:本题考查了常见离子的检验、浓硫酸的性质及化学安全事故处理方法,题目难度中等,试题侧重二氧化硫和亚硫酸盐的性质的考查,明确浓硫酸的化学性质、实验方案的设计原则为解答的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关反应的化学方程式或离子方程式正确的是( )
| A、硫酸铝与过量的氨水反应:Al3++4OH-═AlO2-+2H2O | ||||
| B、除去铁粉中的铝:2Al+2NaOH═2NaAlO2+H2↑ | ||||
C、实验室制取Cl2的离子方程式:MnO2+4HCl(浓)
| ||||
D、浓硫酸与铜的反应:Cu+2H2SO4(浓)
|
下列实验方法正确的是( )
| A、配制一定物质的量浓度的溶液时,若加水超过容量瓶的刻度线,用胶头滴管将多余液体吸出即可 |
| B、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
| C、用CCl4萃取碘水后分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,从漏斗口倒出上层液体 |
| D、检验某溶液中是否含有Fe3+时,可先加入适量的氯水,再滴加硫氰化钾溶液,若溶液变为红色,则说明溶液中一定含有Fe3+ |

 有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24.
有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E<A,R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素,Z原子核外电子数为24. 碳、氮、硫、氯是四种重要的非金属元素.
碳、氮、硫、氯是四种重要的非金属元素.