题目内容
10.已知酸性:H2SO3<H2SO4,某同学在注射器中少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准,如图所示).则下列有关说法正确的是( )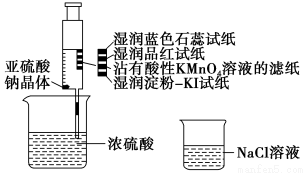
| A. | 蓝色石蕊试纸先变红后褪色 | |
| B. | 品红试纸、蘸有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性 | |
| C. | 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2 | |
| D. | NaCl溶液可用于除去实验中多余的SO2 |
分析 A.SO2只能使酸碱指示剂变色,不能漂白指示剂;
B.SO2具有漂白性,能使品红试纸褪色,SO2具有还原性,与具有强氧化性的KMnO4发生氧化还原反应;
C.根据氧化剂+还原剂→氧化产物+还原产物,氧化性:氧化剂>还原剂分析;
D.SO2为酸性气体,不与NaCl溶液反应.
解答 解:A.SO2只能使酸碱指示剂变色,所以湿润的蓝色石蕊试纸只变红,故A错误;
B.品红试纸褪色,表现出SO2的漂白性,沾有KMnO4溶液的滤纸褪色,表现出SO2的还原性,故B错误;
C.湿润淀粉KI试纸不变蓝,说明SO2不能将KI氧化为I2,则SO2的氧化性弱于I2,故C正确;
D.SO2为酸性气体,有毒,在水溶液中反应生成亚硫酸,此反应是化学平衡,所以与NaCl溶液不反应,不可用于除去实验中多余的SO2,故D错误.
故选C.
点评 本题考查二氧化硫的制备和性质,题目难度中等,注意SO2能使品红溶液褪色、KMnO4褪色的原因不同.

练习册系列答案
相关题目
1.下列是元素周期表的前三周期中的部分元素
(1)表中所标出的元素当中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ne;
(2)K和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为:KOH大于Mg(OH)2(大于/小于);
(3)Si元素位于元素周期表的第三周期第ⅣA族,它的最高价氧化物的化学式是SiO2,由共价键(离子键/共价键)组成;
(4)已知①2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;②Cl2和H2混合,在光照下就可以发生爆炸,生成HCl.据此推断,活泼性比较:O2小于Cl2(大于/小于);另由③Cl2+2NaBr=Br2+2NaCl,可推断氧化性比较:Cl2大于Br2 (大于/小于)
| 族 周 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | Li | C | N | O | F | Ne | ||
| 三 | Na | Mg | S | Cl | ||||
| 四 | K | Ca | Br |
(2)K和Mg两种元素的最高价氧化物对应的水化物都是碱,则这两种碱的碱性强弱为:KOH大于Mg(OH)2(大于/小于);
(3)Si元素位于元素周期表的第三周期第ⅣA族,它的最高价氧化物的化学式是SiO2,由共价键(离子键/共价键)组成;
(4)已知①2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;②Cl2和H2混合,在光照下就可以发生爆炸,生成HCl.据此推断,活泼性比较:O2小于Cl2(大于/小于);另由③Cl2+2NaBr=Br2+2NaCl,可推断氧化性比较:Cl2大于Br2 (大于/小于)
5.根据化学反应的实质是旧键断裂,新键形成这一观点,下列变化不属于化学反应的是( )
| A. | 干冰气化 | B. | O2转变成O3 | C. | 加热NH4HCO3 | D. | 加热NaHCO3 |
15.用价层电子对互斥理论(VSEPR)预测H2S和NF3的立体结构,两个结论都正确的是( )
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
2.下列元素的原子既可以通过离子键,又可以通过共价键形成二元化合物的是( )
| A. | K | B. | Ca | C. | F | D. | Ne |
19.某研究小组为探究Cu的化学性质及溶液环境对反应的影响,设计并完成了下列实验.
Ⅰ.探究Cu的化学性质
(1)根据化合价分析,在化学反应中铜主要体现出的化学性质是还原性.
(2)写出铜与稀硝酸反应的离子方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
(3)向实验①的集气瓶中加水,随着水量的增加,溶液由黄色变为绿色,最后变为蓝色.
【查阅资料】
ⅰ.黄色与蓝色混合呈现绿色.
ⅱ.溶液中存在如下平衡:[Cu(H2O)4]2++4Cl-?[CuCl4]2-+4H2O
利用化学用语和文字解释溶液颜色变化的原因:[CuCl4]2-+4H2O?[Cu(H2O)4]2++4 Cl-,加水过程中,平衡正向移动,随着[Cu(H2O)4]2+的增加,溶液由黄色变为绿色,最后变为蓝色.
(4)反应③中溶液颜色无明显变化,是因为中性环境下反应很难进行.铜表面黑色的物质为CuO,同时有MnO2生成,则中性环境下反应很难进行的原因是:生成的CuO覆盖在铜的表面阻止反应继续.
Ⅱ.探究溶液环境对反应的影响
为进一步研究酸碱性对铜与0.1mol/L KMnO4溶液反应的影响,设计如图实验: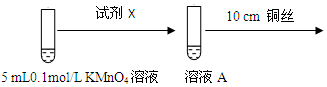
(1)探究酸性条件下反应时,试剂X是.溶液颜色变浅能否说明铜与0.1mol/L KMnO4溶液在酸性条件下发生了反应,理由是如果加入H2SO4溶液的体积是1 mL,对比碱性条件下的实验现象,则能说明发生了反应,如果加入H2SO4溶液的体积是大于1 mL,则有可能是稀释作用导致的溶液颜色变浅.
(2)对于铜与0.1mol/L KMnO4溶液在碱性环境下的反应提出如下假设:
假设Ⅰ:0.1mol/L KMnO4溶液在碱性环境下不能将铜氧化;
假设Ⅱ:0.1mol/L KMnO4溶液在碱性环境下与铜反应较慢.
设计实验验证:
将铜丝紧密缠绕在碳棒上放入碱性的溶液A中,溶液很快由紫红色变为深绿色、.一段时间后,溶液变为浅蓝绿色,试管底部出现棕褐色粉末(MnO2).①反应加快的原因是发生了电化学腐蚀,其正极发生的电极反应式为:MnO4-+e-→MnO42-、MnO42-+2e-+2H2O=MnO2+4OH-.
②通过上述实验得出结论.
Ⅰ.探究Cu的化学性质
| 实验 | 试剂1 | 试剂2 | 操作及现象 |
| ① | 铜丝 | 氯气 | 将加热后的铜丝伸入盛有氯气的集气瓶中,产生棕黄色的烟 |
| ② | 稀硝酸 | 产生无色气体,遇空气变为红棕色 | |
| ③ | 0.1mol/LKMnO4溶液 | 加热后,铜丝表面有黑色物质,溶液颜色无明显变化 |
(2)写出铜与稀硝酸反应的离子方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
(3)向实验①的集气瓶中加水,随着水量的增加,溶液由黄色变为绿色,最后变为蓝色.
【查阅资料】
ⅰ.黄色与蓝色混合呈现绿色.
ⅱ.溶液中存在如下平衡:[Cu(H2O)4]2++4Cl-?[CuCl4]2-+4H2O
利用化学用语和文字解释溶液颜色变化的原因:[CuCl4]2-+4H2O?[Cu(H2O)4]2++4 Cl-,加水过程中,平衡正向移动,随着[Cu(H2O)4]2+的增加,溶液由黄色变为绿色,最后变为蓝色.
(4)反应③中溶液颜色无明显变化,是因为中性环境下反应很难进行.铜表面黑色的物质为CuO,同时有MnO2生成,则中性环境下反应很难进行的原因是:生成的CuO覆盖在铜的表面阻止反应继续.
Ⅱ.探究溶液环境对反应的影响
为进一步研究酸碱性对铜与0.1mol/L KMnO4溶液反应的影响,设计如图实验:

| 环境 | 反应现象 |
| 酸性 | 溶液紫红色变浅 |
| 碱性(1mL 1mol/L NaOH溶液) | 无明显现象 |
(2)对于铜与0.1mol/L KMnO4溶液在碱性环境下的反应提出如下假设:
假设Ⅰ:0.1mol/L KMnO4溶液在碱性环境下不能将铜氧化;
假设Ⅱ:0.1mol/L KMnO4溶液在碱性环境下与铜反应较慢.
设计实验验证:
将铜丝紧密缠绕在碳棒上放入碱性的溶液A中,溶液很快由紫红色变为深绿色、.一段时间后,溶液变为浅蓝绿色,试管底部出现棕褐色粉末(MnO2).①反应加快的原因是发生了电化学腐蚀,其正极发生的电极反应式为:MnO4-+e-→MnO42-、MnO42-+2e-+2H2O=MnO2+4OH-.
②通过上述实验得出结论.