题目内容
19.某研究小组为探究Cu的化学性质及溶液环境对反应的影响,设计并完成了下列实验.Ⅰ.探究Cu的化学性质
| 实验 | 试剂1 | 试剂2 | 操作及现象 |
| ① | 铜丝 | 氯气 | 将加热后的铜丝伸入盛有氯气的集气瓶中,产生棕黄色的烟 |
| ② | 稀硝酸 | 产生无色气体,遇空气变为红棕色 | |
| ③ | 0.1mol/LKMnO4溶液 | 加热后,铜丝表面有黑色物质,溶液颜色无明显变化 |
(2)写出铜与稀硝酸反应的离子方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
(3)向实验①的集气瓶中加水,随着水量的增加,溶液由黄色变为绿色,最后变为蓝色.
【查阅资料】
ⅰ.黄色与蓝色混合呈现绿色.
ⅱ.溶液中存在如下平衡:[Cu(H2O)4]2++4Cl-?[CuCl4]2-+4H2O
利用化学用语和文字解释溶液颜色变化的原因:[CuCl4]2-+4H2O?[Cu(H2O)4]2++4 Cl-,加水过程中,平衡正向移动,随着[Cu(H2O)4]2+的增加,溶液由黄色变为绿色,最后变为蓝色.
(4)反应③中溶液颜色无明显变化,是因为中性环境下反应很难进行.铜表面黑色的物质为CuO,同时有MnO2生成,则中性环境下反应很难进行的原因是:生成的CuO覆盖在铜的表面阻止反应继续.
Ⅱ.探究溶液环境对反应的影响
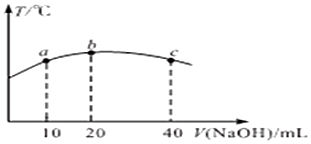
为进一步研究酸碱性对铜与0.1mol/L KMnO4溶液反应的影响,设计如图实验:
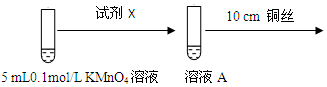
| 环境 | 反应现象 |
| 酸性 | 溶液紫红色变浅 |
| 碱性(1mL 1mol/L NaOH溶液) | 无明显现象 |
(2)对于铜与0.1mol/L KMnO4溶液在碱性环境下的反应提出如下假设:
假设Ⅰ:0.1mol/L KMnO4溶液在碱性环境下不能将铜氧化;
假设Ⅱ:0.1mol/L KMnO4溶液在碱性环境下与铜反应较慢.
设计实验验证:
将铜丝紧密缠绕在碳棒上放入碱性的溶液A中,溶液很快由紫红色变为深绿色、.一段时间后,溶液变为浅蓝绿色,试管底部出现棕褐色粉末(MnO2).①反应加快的原因是发生了电化学腐蚀,其正极发生的电极反应式为:MnO4-+e-→MnO42-、MnO42-+2e-+2H2O=MnO2+4OH-.
②通过上述实验得出结论.
分析 Ⅰ.探究Cu的化学性质:(1)氧化还原反应中,失去电子的反应物为还原剂,表现还原性,铜为金属,在氧化还原反应中易失去电子,化合价升高,表现出还原性;
(2)铜和稀硝酸反应生成硝酸铜、一氧化氮和水;
(3)黄色与蓝色混合呈现绿色,氯化铜在溶液中为蓝绿色,氯化铜在溶液中以[Cu(H2O)4]2+存在,加水过程中,随着[Cu(H2O)4]2+的增加,其浓度不同,颜色不同;
【查阅资料】(4)铜在空气中加热生成氧化铜,在中性溶液中氧化铜不溶解,阻碍铜与KMnO4溶液反应.
Ⅱ.(1)因高锰酸钾具有强氧化性,所以选择酸为非还原性的酸;对照实验需除酸碱性不同,其它条件都相同,该实验需体积、浓度相同;
(2)①电化学腐蚀,正极上高锰酸根离子得电子生成锰酸根离子,锰酸根离子得电子生成棕褐色MnO2和氢氧根离子;
②将铜丝紧密缠绕在碳棒上放入碱性的溶液A中,试管底部出现棕褐色粉末,发生电化学腐蚀,说明碱性条件下铜单质可以与KMnO4溶液发生氧化还原反应,对照实验说明反应速度很慢,(或假设Ⅱ成立).
解答 解:Ⅰ.探究Cu的化学性质:(1)铜和氯气反应生成氯化铜,铜元素的化合价变化为0价升高为+2价,表现出还原性,铜与稀硝酸反应生成硝酸铜,铜元素的化合价变化为0价升高为+2价,表现出还原性,铜丝加热后,铜丝表面有黑色物质,生成氧化铜,铜元素的化合价变化为0价升高为+2价,表现出还原性,所以根据化合价分析,在化学反应中铜主要体现出的化学性质是还原性,
故答案为:还原性;
(2)铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)氯化铜在溶液中:[CuCl4]2-+4H2O?[Cu(H2O)4]2++4 Cl-,以[Cu(H2O)4]2+存在,其浓度不同,颜色不同,加水过程中,平衡正向移动,随着[Cu(H2O)4]2+的增加,溶液由黄色变为绿色,最后变为蓝色,
故答案为:[CuCl4]2-+4H2O?[Cu(H2O)4]2++4 Cl-,加水过程中,平衡正向移动,随着[Cu(H2O)4]2+的增加,溶液由黄色变为绿色,最后变为蓝色;
【查阅资料】(4)铜在空气中加热生成氧化铜,反应③中溶液颜色无明显变化,是因为中性环境下,铜表面黑色的CuO,不溶解,阻碍铜与KMnO4溶液反应,
故答案为:生成的CuO覆盖在铜的表面阻止反应继续继续;
Ⅱ.(1)因高锰酸钾具有强氧化性,所以选择酸为非还原性的酸,所以探究酸性条件下反应时,试剂X是H2SO4溶液,对照实验需除酸碱性不同,其它条件都相同,如果加入H2SO4溶液的体积是1 mL,对比碱性条件下的实验现象,则能说明发生了反应,如果加入H2SO4溶液的体积是大于1 mL,则有可能是稀释作用导致的溶液颜色变浅,
故答案为:H2SO4溶液;如果加入H2SO4溶液的体积是1 mL,对比碱性条件下的实验现象,则能说明发生了反应,如果加入H2SO4溶液的体积是大于1 mL,则有可能是稀释作用导致的溶液颜色变浅;
(2)①电化学腐蚀,正极上发生还原反应,高锰酸根离子得电子生成锰酸根离子,MnO4-+e-→MnO42-,锰酸根离子得电子生成棕褐色MnO2和氢氧根离子,MnO42-+2e-+2H2O=MnO2+4OH-,
故答案为:MnO4-+e-→MnO42-、MnO42-+2e-+2H2O=MnO2+4OH-;
②探究溶液环境对反应的影响,将铜丝紧密缠绕在碳棒上放入碱性的溶液A中,溶液很快由紫红色变为深绿色,一段时间后,试管底部出现棕褐色粉末,发生电化学腐蚀,对照碱性(1mL 1mol/L NaOH溶液),无明显现象,说明碱性条件下铜单质可以与KMnO4溶液发生氧化还原反应,但反应速度很慢,(或假设Ⅱ成立),
答:碱性条件下铜单质可以与KMnO4溶液发生氧化还原反应,但反应速度很慢,(或假设Ⅱ成立).
点评 本题考查了探究Cu的化学性质及溶液环境对反应的影响实验,掌握铜及其化合物的性质以及高锰酸根的性质是解答关键,侧重学生实验能力和分析能力的考查,注意电化学高频考点的掌握,题目难度中等.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案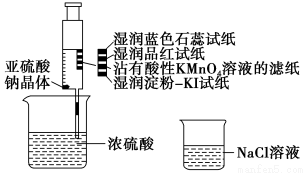
| A. | 蓝色石蕊试纸先变红后褪色 | |
| B. | 品红试纸、蘸有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性 | |
| C. | 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2 | |
| D. | NaCl溶液可用于除去实验中多余的SO2 |
| A. | CO2的电子式 | B. | Cl2的结构式:Cl-Cl | ||
| C. | CH4的球棍模型 | D. | Clˉ离子的结构示意图  |
| A. | FeCl2溶液 | B. | 溴水 | C. | NaOH溶液 | D. | 水 |
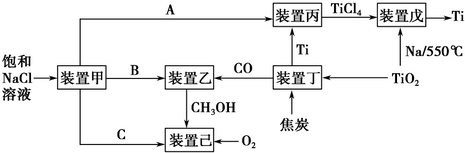
请回答下列问题:
(1)装置甲为电解池(惰性电极),根据图示转化关系可知:A为Cl2(填化学式),阴极反应式为2H++2e-=H2 ↑.
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是进入装置丙的Ti含有的杂质较多,从装置戊中出来的Ti较为纯净装置戊进行反应时需要的环境为C(填字母序号).
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)=CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
A.0 B.0.012 C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
| c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
A.使用催化剂 B.降低温度 C.增加H2的浓度.
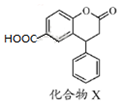
| A. | X的分子式为C16H11O4 | |
| B. | X分子中有三种不同的官能团 | |
| C. | 1 mol化合物X最多能与3 mol NaOH反应 | |
| D. | X分子中两个苯环一定处于同一平面 |