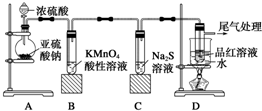
题目内容
15.用价层电子对互斥理论(VSEPR)预测H2S和NF3的立体结构,两个结论都正确的是( )| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
分析 价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果.价层电子对就是指分子中的中心原子上的电子对,包括σ 键电子对和中心原子上的孤电子对;σ 键电子对数和中心原子上的孤电子对数之和就是价层电子对数,孤电子对数=$\frac{1}{2}$(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数,由于价层电子对的相互排斥,就可得到含有孤电子对的VSEPR模型,略去孤电子对就是该分子的空间构型.
解答 解:H2S分子的中心原子S原子上含有2个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(6-2×1)=2,所以硫化氢分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;
NF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(5-3×1)=1,所以NF3分子的VSEPR模型是四面体型,略去孤电子对后,其空间构型是三角锥形.
故选B.
点评 本题考查了分子空间构型的判断,题目难度中等,易错点是阴阳离子中孤电子对数的确定,注意中心原子上的孤电子对数=$\frac{1}{2}$(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
5.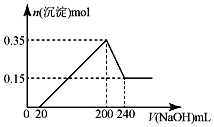 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )| A. | NaOH溶液的物质的量浓度为2.5mol•L-1 | |
| B. | 盐酸的物质的量浓度为5mol•L-1 | |
| C. | 镁和铝的总质量为9g | |
| D. | 生成的氢气在标准状况下的体积为11.2L |
6.已知20℃,两种一元弱酸的钠盐NaX和NaY,已知往NaX溶液中通入少量CO2只能生成HX和NaHCO3;往NaY溶液中通入少量CO2能生成HY和Na2CO3,下列说法正确的是( )
| A. | 酸性HX<HY | |
| B. | 结合H+的能力Y->CO32->X->HCO3- | |
| C. | 溶液的碱性NaX>Na2CO3>NaY>NaHCO3 | |
| D. | HX和HY酸性相同,但比H2CO3弱 |
3.X、Y、Z、W均为短周期元素,原子序数依次增大.Y原子的M电子层有1个电子,同周期的简单离子的半径中Z最小.W与X同主族,其最高化合价是最低负化合价绝对值的3倍.下列说法正确的是( )
| A. | 原子半径的大小:W>Z>Y | |
| B. | 简单气态氢化物的热稳定性:W>X | |
| C. | Y、Z、W最高价氧化物对应水化物能够两两发生反应 | |
| D. | 简单离子的还原性:X>W |
10.已知酸性:H2SO3<H2SO4,某同学在注射器中少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准,如图所示).则下列有关说法正确的是( )
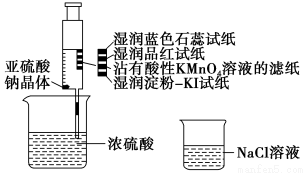

| A. | 蓝色石蕊试纸先变红后褪色 | |
| B. | 品红试纸、蘸有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性 | |
| C. | 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2 | |
| D. | NaCl溶液可用于除去实验中多余的SO2 |
4.下列表示不正确的是( )
| A. | CO2的电子式 | B. | Cl2的结构式:Cl-Cl | ||
| C. | CH4的球棍模型 | D. | Clˉ离子的结构示意图  |