题目内容
2.取500mL Na2CO3溶液与300mL 1mol/L盐酸反应,在不断搅拌下将碳酸钠溶液逐滴滴入盐酸中与将盐酸逐滴滴入碳酸钠溶液中,所产生气体的物质的量之比为3:2.则碳酸钠溶液的物质的量浓度( )| A. | 0.4mol/L | B. | 0.3mol/L | C. | 0.2mol/L | D. | 0.5mol/L |
分析 将碳酸钠溶液逐滴滴入盐酸中,盐酸过量,发生反应是Na2CO3+2HCl=2NaCl+CO2↑+H2O,将盐酸逐滴滴入碳酸钠溶液中,碳酸钠过量,首先发生的反应是Na2CO3+HCl=NaHCO3+NaCl,碳酸钠反应完后,再发生反应是NaHCO3+HCl=NaCl+CO2+H2O,如果对两个过程,盐酸都过量,则两次产生CO2应该一样多,但两者不同,说明在第一个过程中盐酸完全反应,碳酸钠有剩余,第二过程中盐酸也完全反应,但有碳酸氢钠剩余.
根据HCl的物质的量计算第一个过程的二氧化碳的物质的量,进而计算第二个过程生成二氧化碳的物质的量,根据方程式:NaHCO3+HCl=NaCl+CO2+H2O计算参加该反应的HCl的物质的量,进而计算反应:Na2CO3+HCl=NaHCO3+NaCl中消耗的HCl的物质的量,据此计算Na2CO3的物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:将盐酸滴入碳酸钠溶液中,发生反应:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+CO2↑+H2O,将碳酸钠溶液滴入盐酸中,发生反应:Na2CO3+2HCl═2NaCl+CO2↑+H2O,若盐酸均足量,生成二氧化碳体积相等,而实际生成二氧化碳的体积之比为3:2,故盐酸不足,HCl物质的量为0.3L×1mol/L=0.3mol,故碳酸钠溶液滴入盐酸中生成二氧化碳的物质的量为0.3mol×$\frac{1}{2}$=0.15mol,则盐酸滴入碳酸钠溶液中生成二氧化碳的物质的量为0.15mol×$\frac{2}{3}$=0.1mol,故反应NaHCO3+HCl=NaCl+CO2+H2O中消耗的HCl为0.1mol,反应Na2CO3+HCl=NaHCO3+NaCl中消耗的HCl为0.3mol-0.1mol=0.2mol,故碳酸钠的物质的量为0.2mol,物质的量浓度为$\frac{0.2mol}{0.5L}$=0.4mol/L,
故选A.
点评 本题考查化学方程式有关计算,明确盐酸与碳酸钠反应,滴加顺序不同发生反应不同是解题关键,侧重考查学生分析计算能力,题目难度中等.

| A. | 工业上电解饱和食盐水的阳极反应为:2Cl--2e-═Cl2↑ | |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 铁表面镀锌,铁作阳极 |
| A. | 食盐水 | B. | 干冰 | C. | 氯水 | D. | 浓硝酸 |
| A. | 溶剂的质量 | B. | 溶质的质量分数 | ||
| C. | NH4Cl的溶解度 | D. | 溶液中NH4+的数目 |
| A. | 极易溶于水 | B. | 分子为平面正六边形结构 | ||
| C. | 是衡量石油化工发展水平的标志 | D. | 能使紫色的酸性KMnO4溶液褪色 |
| A. | 正极为Fe、负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为Ag、负极为Fe,电解质溶液为CuSO4溶液 | |
| C. | 正极为Fe、负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为C、负极为Fe,电解质溶液为Fe(NO3)3溶液 |
| A. | 吸热反应一定是非自发的化学反应,放热反应不需要加热就能发生反应 | |
| B. | 其它条件不变时,增大压强可以增大活化分子百分数,使化学反应速率加快 | |
| C. | 温度、压强一定时,熵增加的反应都能自发进行 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| A. | ${\;}_{1}^{2}$H、${\;}_{1}^{1}$H | B. | 红磷、白磷 | ||
| C. | Na2O、Na2O2 | D. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca |

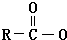 Na+NaOH$→_{△}^{CaO}$R-H+Na2CO3
Na+NaOH$→_{△}^{CaO}$R-H+Na2CO3 ,K的结构简式为
,K的结构简式为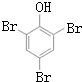 .
.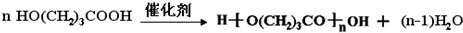 ;
;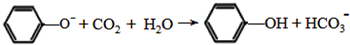 .
. (写结构简式).
(写结构简式).