题目内容
7.有关苯的说法正确的是( )| A. | 极易溶于水 | B. | 分子为平面正六边形结构 | ||
| C. | 是衡量石油化工发展水平的标志 | D. | 能使紫色的酸性KMnO4溶液褪色 |
分析 A.依据相似相容原理解答;
B.依据苯分子为平面正六边形结构解答;
C.乙烯是衡量石油化工发展水平的标志;
D.苯不含碳碳双键,与高锰酸钾不反应.
解答 解:A.苯是有机物,难溶于水,故A错误;
B.苯分子为平面正六边形结构,故B正确;
C.衡量石油化工发展水平的标志是乙烯,不是苯,故C错误;
D.苯不能够酸性的高锰酸钾反应,不能使高锰酸钾褪色,故D错误;
故选:B.
点评 本题考查了苯的结构与性质,明确苯分子中碳碳键是介于单键与双键之间独特的化学键是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.用氯气消毒过的自来水配制下列溶液时,会使所配溶液的溶质发生变化的是( )
①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤FeCl2.
①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤FeCl2.
| A. | 只有①② | B. | 只有①④⑤ | C. | 只有②④⑤ | D. | ①②③④⑤ |
15.下列关于硫酸的叙述正确的是( )
| A. | 浓硫酸具有吸水性 | B. | 稀硫酸可用铁罐贮存 | ||
| C. | 稀硫酸能使蔗糖脱水 | D. | SO2溶于水,可得到稀硫酸 |
2.取500mL Na2CO3溶液与300mL 1mol/L盐酸反应,在不断搅拌下将碳酸钠溶液逐滴滴入盐酸中与将盐酸逐滴滴入碳酸钠溶液中,所产生气体的物质的量之比为3:2.则碳酸钠溶液的物质的量浓度( )
| A. | 0.4mol/L | B. | 0.3mol/L | C. | 0.2mol/L | D. | 0.5mol/L |
12.对于反应A2+3B2═2C来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=1.2mol/(L•s) | B. | v(A2)=0.4 mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(B2)=0.8 mol/(L•s) |
19.下列物质中,可作为绿色燃料的是( )
| A. | 汽油 | B. | 煤 | C. | 石油 | D. | 氢气 |
16.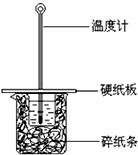 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )
 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )| A. | 采用0.55mol/L的NaOH溶液是保证盐酸完全被中和 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是保温隔热,防止热量损失 | |
| D. | 若烧杯上不盖硬纸板,测得的△H将偏小 |
17.下表列出A~K九种元素在周期表中的位置:
(1)请写出下列元素的元素符号ANaBKDAlGO..
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(3)ABC这三种元素的原子半径由大到小的顺序排列为K>Na>Mg.(写出元素符号)
(4)G元素氢化物的化学式是H2O,该氢化物在常温下跟B反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的PH>7.(填>、=、<)
(5)在该周期表中,最高价氧化物对应的水化物中碱性最强的是KOH;最高价氧化物对应的水化物中酸性最强的是HClO4;气态氢化物最稳定的是HF.(写出物质的化学式)
| 周 期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VII A | 0 |
| 2 | E | G | H | |||||
| 3 | A | C | D | I | K | |||
| 4 | B | J |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(3)ABC这三种元素的原子半径由大到小的顺序排列为K>Na>Mg.(写出元素符号)
(4)G元素氢化物的化学式是H2O,该氢化物在常温下跟B反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的PH>7.(填>、=、<)
(5)在该周期表中,最高价氧化物对应的水化物中碱性最强的是KOH;最高价氧化物对应的水化物中酸性最强的是HClO4;气态氢化物最稳定的是HF.(写出物质的化学式)
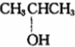 ⑨${\;}_{6}^{13}$C
⑨${\;}_{6}^{13}$C 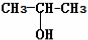 .
.