题目内容
13.下列叙述不正确的是( )| A. | 工业上电解饱和食盐水的阳极反应为:2Cl--2e-═Cl2↑ | |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 铁表面镀锌,铁作阳极 |
分析 A、电解饱和食盐水时,阳极上氯离子放电;
B、在原电池中,活泼的做负极;
C、钢铁的吸氧腐蚀中,正极上氧气放电;
D、在铁表面镀锌,需要将锌先反应为锌离子,然后在铁表面析出.
解答 解:A、电解饱和食盐水时,阳极上氯离子放电,电极反应为2Cl--2e-═Cl2↑,故A正确;
B、在原电池中,活泼的做负极,与轮船形成原电池,锌作负极,船体做正极被保护,故B正确;
C、钢铁的吸氧腐蚀中,正极上氧气放电,电极反应为:O2+2H2O+4e-═4OH-,故C正确;
D、在铁表面镀锌,需要将锌先反应为锌离子,然后在铁表面析出,故锌应做阳极,故D错误.
故选D.
点评 本题考查了电化学腐蚀与防护、电镀原理的应用,应注意的是在原电池中正极被保护、在电解池中阴极被保护,难度不大.

练习册系列答案
相关题目
3.决定气体体积的主要微观因素是( )
| A. | 气体分子的数目和分子本身的大小 | |
| B. | 气体分子的质量和分子本身的大小 | |
| C. | 气体分子本身的大小和分子间的平均距离 | |
| D. | 气体分子的数目和分子间的平均距离 |
4.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 1 mol甲基的电子数目为7NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其所含原子总数为3NA |
1. 在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )
在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )
 在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )
在AlCl3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中AlCl3与MgSO4的物质的量浓度之比为( )| A. | 1:1 | B. | 3:1 | C. | 2:1 | D. | 1:2 |
8.Se、Br两种元素的部分信息如图所示,下列说法正确的是( )
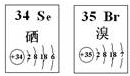

| A. | 原子半径:Br>Se>P | B. | 还原性:S 2 ->Se 2 ->Br - | ||
| C. | SeO 2既有氧化性又有还原性 | D. | 在Se2Br2分子中只含有极性键 |
18.用氯气消毒过的自来水配制下列溶液时,会使所配溶液的溶质发生变化的是( )
①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤FeCl2.
①NaOH ②AgNO3 ③Na2CO3 ④NaBr ⑤FeCl2.
| A. | 只有①② | B. | 只有①④⑤ | C. | 只有②④⑤ | D. | ①②③④⑤ |
5.已知下列反应:①2BrO3-+Cl2=Br2+2ClO3- ②5Cl2+I2+6H2O=2HIO3+10HCl ③ClO3-+5Cl-+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序正确的是( )
| A. | ClO3->BrO3->IO3->Cl2 | B. | ClO3->BrO3->Cl2>IO3- | ||
| C. | BrO3->ClO3->Cl2>IO3- | D. | Cl2>BrO3->ClO3->IO3- |
2.取500mL Na2CO3溶液与300mL 1mol/L盐酸反应,在不断搅拌下将碳酸钠溶液逐滴滴入盐酸中与将盐酸逐滴滴入碳酸钠溶液中,所产生气体的物质的量之比为3:2.则碳酸钠溶液的物质的量浓度( )
| A. | 0.4mol/L | B. | 0.3mol/L | C. | 0.2mol/L | D. | 0.5mol/L |
3.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率.进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+2I-=2SO42-+I2
(1)实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌.
在反应(1)进行的同时,发生反应:2S2O32-+I2=S4O62-+2I-
(2)反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-.S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色.从加入(NH4)2S2O8溶液到出现蓝色的时间为△t.
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上.
a=8.0 b=5 c=15
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是搅拌.
(3)第①组实验的v(S2O82-)=2.5×10-5mol•(L•s)-1.
(4)根据上表数据分析,可以得到的结论有(写出一条即可)S2O82-或I-的浓度越小,反应速率越慢.
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+2I-=2SO42-+I2
(1)实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌.
在反应(1)进行的同时,发生反应:2S2O32-+I2=S4O62-+2I-
(2)反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-.S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色.从加入(NH4)2S2O8溶液到出现蓝色的时间为△t.
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上.
| 实 验 编 号 | ① | ② | ③ | ④ | ⑤ | |
试剂 用量 (mL) | 0.20mol•L-1(NH4)2 S2O8溶液 | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20mol•L-1KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010mol•L-1 Na2S2O3溶液 | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20mol•L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | c | |
| 0.20mol•L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间△t(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是搅拌.
(3)第①组实验的v(S2O82-)=2.5×10-5mol•(L•s)-1.
(4)根据上表数据分析,可以得到的结论有(写出一条即可)S2O82-或I-的浓度越小,反应速率越慢.