题目内容
12.下列属于同位素的一组是( )| A. | ${\;}_{1}^{2}$H、${\;}_{1}^{1}$H | B. | 红磷、白磷 | ||
| C. | Na2O、Na2O2 | D. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca |
分析 同位素的概念:具有相同质子数,不同中子数的同一元素的不同原子互为同位素,把握同位素必须是原子,以此来解答.
解答 解:A、${\;}_{1}^{2}$H和${\;}_{1}^{1}$H质子数相同,均为1,中子数不同,分别为1、0,是同种元素的不同的原子,互为同位素,故A正确;
B、红磷、白磷都是由磷元素组成的不同形态的单质,互称为同素异形体,故B错误;
C、Na2O和Na2O2是两种化合物,不是原子间关系,不符合同位素的概念,故C错误;
D、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca具有的质子数不同,因此不属于同位素,故D错误;
故选A.
点评 本题考查同位素的判断,明确同位素的研究对象是原子是解答本题的关键,难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
2.取500mL Na2CO3溶液与300mL 1mol/L盐酸反应,在不断搅拌下将碳酸钠溶液逐滴滴入盐酸中与将盐酸逐滴滴入碳酸钠溶液中,所产生气体的物质的量之比为3:2.则碳酸钠溶液的物质的量浓度( )
| A. | 0.4mol/L | B. | 0.3mol/L | C. | 0.2mol/L | D. | 0.5mol/L |
3.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率.进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+2I-=2SO42-+I2
(1)实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌.
在反应(1)进行的同时,发生反应:2S2O32-+I2=S4O62-+2I-
(2)反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-.S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色.从加入(NH4)2S2O8溶液到出现蓝色的时间为△t.
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上.
a=8.0 b=5 c=15
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是搅拌.
(3)第①组实验的v(S2O82-)=2.5×10-5mol•(L•s)-1.
(4)根据上表数据分析,可以得到的结论有(写出一条即可)S2O82-或I-的浓度越小,反应速率越慢.
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+2I-=2SO42-+I2
(1)实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌.
在反应(1)进行的同时,发生反应:2S2O32-+I2=S4O62-+2I-
(2)反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-.S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色.从加入(NH4)2S2O8溶液到出现蓝色的时间为△t.
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上.
| 实 验 编 号 | ① | ② | ③ | ④ | ⑤ | |
试剂 用量 (mL) | 0.20mol•L-1(NH4)2 S2O8溶液 | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20mol•L-1KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010mol•L-1 Na2S2O3溶液 | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20mol•L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | c | |
| 0.20mol•L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间△t(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是搅拌.
(3)第①组实验的v(S2O82-)=2.5×10-5mol•(L•s)-1.
(4)根据上表数据分析,可以得到的结论有(写出一条即可)S2O82-或I-的浓度越小,反应速率越慢.
20.在0.1mol•L-1醋酸溶液中加入少量0.1mol•L-1盐酸,下列叙述正确的是( )
| A. | CH3COOH的电离程度增大,c(H+)增大 | |
| B. | 平衡向生成CH3COOH移动,c(H+)减小 | |
| C. | CH3COOH电离程度减小,pH减小 | |
| D. | 电离平衡向生成CH3COO-、H+方向移动,pH减小 |
17.下表列出A~K九种元素在周期表中的位置:
(1)请写出下列元素的元素符号ANaBKDAlGO..
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(3)ABC这三种元素的原子半径由大到小的顺序排列为K>Na>Mg.(写出元素符号)
(4)G元素氢化物的化学式是H2O,该氢化物在常温下跟B反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的PH>7.(填>、=、<)
(5)在该周期表中,最高价氧化物对应的水化物中碱性最强的是KOH;最高价氧化物对应的水化物中酸性最强的是HClO4;气态氢化物最稳定的是HF.(写出物质的化学式)
| 周 期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VII A | 0 |
| 2 | E | G | H | |||||
| 3 | A | C | D | I | K | |||
| 4 | B | J |
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
(3)ABC这三种元素的原子半径由大到小的顺序排列为K>Na>Mg.(写出元素符号)
(4)G元素氢化物的化学式是H2O,该氢化物在常温下跟B反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的PH>7.(填>、=、<)
(5)在该周期表中,最高价氧化物对应的水化物中碱性最强的是KOH;最高价氧化物对应的水化物中酸性最强的是HClO4;气态氢化物最稳定的是HF.(写出物质的化学式)
4. A到F是原子序数依次增大的前四周期元素:
A到F是原子序数依次增大的前四周期元素:
回答下列问题:
(1)写出E、F的元素符号Mg、Cr,B、C、D元素的第一电离能由大到小的顺序为N>O>C(用元素符号表示),A元素分别与B、D元素形成的两种微粒都具有与NH3相似的结构,属于等电子体,它们的化学式依次是CH3-、H3O+.
(2)在CH3Cl、C6H6、HCHO、CH3OH、CH≡CH中,碳原子采取sp2杂化的有C6H6、HCHO;应用价层电子对互斥理论,预测COCl2的空间构型为平面三角形.
(3)F元素的原子基态价层电子排布图是 .
.
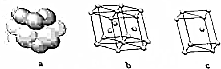
(4)E单质晶体中原子的堆积模型如图,晶胞是图中的c(填“a”、“b”或“c”);配位数是12‘若紧邻的四个E原子的中心连线构成的几何体的体积是Vcm3,E单质的密度为ρg•cm-3,则E的相对原子质量是计算式是6NA•V•ρ.
 A到F是原子序数依次增大的前四周期元素:
A到F是原子序数依次增大的前四周期元素:| A | A是原子半径最小的元素 |
| B | B基态原子的价层电子排布式为nsnnpn |
| D | D原子最外层电子数是次外层电子数的三倍 |
| E | C的三价阴离子和E的二价阳离子具有相同的电子层结构 |
| F | F元素的基态原子有六个成单电子 |
(1)写出E、F的元素符号Mg、Cr,B、C、D元素的第一电离能由大到小的顺序为N>O>C(用元素符号表示),A元素分别与B、D元素形成的两种微粒都具有与NH3相似的结构,属于等电子体,它们的化学式依次是CH3-、H3O+.
(2)在CH3Cl、C6H6、HCHO、CH3OH、CH≡CH中,碳原子采取sp2杂化的有C6H6、HCHO;应用价层电子对互斥理论,预测COCl2的空间构型为平面三角形.
(3)F元素的原子基态价层电子排布图是
 .
.(4)E单质晶体中原子的堆积模型如图,晶胞是图中的c(填“a”、“b”或“c”);配位数是12‘若紧邻的四个E原子的中心连线构成的几何体的体积是Vcm3,E单质的密度为ρg•cm-3,则E的相对原子质量是计算式是6NA•V•ρ.
1.下列说法正确的是( )
| A. | 漂白粉漂白物质时发生的发应和变质失效时的反应一样 | |
| B. | 将氯气溶于水中,当水中各成分浓度保持不变时,即表示反应停止 | |
| C. | 二氧化硅固体是由原子直接构成的,那么固态二氧化碳也是由原子直接构成 | |
| D. | 碱金属(如钾、钠等)可以存放在所有有机溶剂中,而白磷则应保存在水中 |
2.常温时,将某浓度的CH3COOH溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应生成盐和水(若混合体积变化忽略不计),则下列有关所得混合液的说法正确的是( )
| A. | 混合后溶液pH=7 | |
| B. | 所得混合溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 所得混合溶液中存在c(CH3COOH)+c(CH3COO-)=0.05molL-1 | |
| D. | 混合后溶液中存在c(Na+)+c(H+)=c(CH3COOH)+c(CH3COO-) |
 .
. .
.