题目内容
17.将40℃的饱和NH4Cl溶液冷却至10℃,有NH4Cl固体析出.该过程中保持不变的是( )| A. | 溶剂的质量 | B. | 溶质的质量分数 | ||
| C. | NH4Cl的溶解度 | D. | 溶液中NH4+的数目 |
分析 将40℃的饱和NH4Cl溶液冷却至10℃,NH4Cl的溶解度减小,析出晶体,且仍为饱和溶液,根据一定温度下,饱和溶液的溶质质量分数:$\frac{溶解度}{100+溶解度}$×100%,可知溶液的溶质质量分数减小,但溶剂不变.
解答 解:A.在降温过程中,水的质量不变.故A正确;
B.在降温过程中,饱和溶液的溶质质量分数:$\frac{溶解度}{100+溶解度}$×100%,溶质质量减小,溶剂不变,所以溶质质量分数减小,故B错误;
C.NH4Cl的溶解度与温度有关,温度越高溶解度越大,所以降低温度,溶解度减小,故C错误;
D.饱和NH4Cl溶液冷却,NH4Cl的溶解度减小,析出晶体,所以溶液中NH4+的数目减少,故D错误;
故选A.
点评 本题考查饱和溶液冷却结晶有关知识,解答本题要掌握物质的溶解度与温度变化之间的关系,并且把溶质、溶剂、溶质质量分数联系起来进行分析、判断,从而得出正确的结论,题目难度不大.

练习册系列答案
相关题目
8.Se、Br两种元素的部分信息如图所示,下列说法正确的是( )
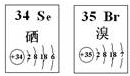

| A. | 原子半径:Br>Se>P | B. | 还原性:S 2 ->Se 2 ->Br - | ||
| C. | SeO 2既有氧化性又有还原性 | D. | 在Se2Br2分子中只含有极性键 |
5.已知下列反应:①2BrO3-+Cl2=Br2+2ClO3- ②5Cl2+I2+6H2O=2HIO3+10HCl ③ClO3-+5Cl-+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序正确的是( )
| A. | ClO3->BrO3->IO3->Cl2 | B. | ClO3->BrO3->Cl2>IO3- | ||
| C. | BrO3->ClO3->Cl2>IO3- | D. | Cl2>BrO3->ClO3->IO3- |
2.取500mL Na2CO3溶液与300mL 1mol/L盐酸反应,在不断搅拌下将碳酸钠溶液逐滴滴入盐酸中与将盐酸逐滴滴入碳酸钠溶液中,所产生气体的物质的量之比为3:2.则碳酸钠溶液的物质的量浓度( )
| A. | 0.4mol/L | B. | 0.3mol/L | C. | 0.2mol/L | D. | 0.5mol/L |
9.下列物质不能与金属钠反应的是( )
| A. | 水 | B. | 煤油 | C. | 盐酸 | D. | 乙醇 |
6.在下列有机物分子中,所有原子不可能处于同一平面的是( )
| A. | CH2=CH-CN | B. | CH2=CH-CH=CH2 | C. |  | D. |  |
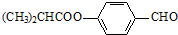 .合成M的一种途径如下:
.合成M的一种途径如下:
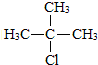 ,D中官能团的名称是羧基.
,D中官能团的名称是羧基.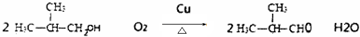 .
. .
.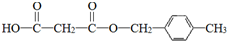 .
.
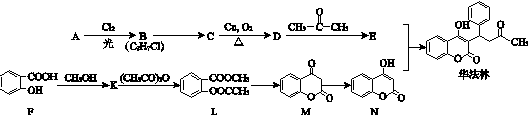
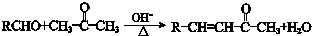
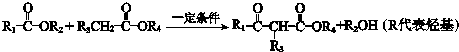
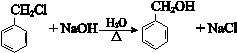 .
. .
.