题目内容
13.①肼(N2H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:N2H4+H2O?NH2NH3++OH-②传统制备肼(N2H4)的方法是以NaClO氧化NH3制得肼的稀溶液,该反应的化学方程式:NaClO+2NH3═N2H4+NaCl+H2O.
分析 ①肼(N2H4)溶于水显碱性,其原理与氨相似,类比一水合氨的电离方程式书写;
②以NaClO氧化NH3制得肼,根据化合价升降相等配平.
解答 解:①肼(N2H4)溶于水显碱性,其原理与氨相似,结合一水合氨的电离方程式可知,肼(N2H4)溶于水电离出NH2NH3+、OH-,其电离方程式为:N2H4+H2O?NH2NH3++OH-,
故答案为:N2H4+H2O?NH2NH3++OH-;
②传统制备肼(N2H4)的方法是以NaClO氧化NH3制得肼的稀溶液,NaClO中+1价氯元素被还原生成-1价,化合价降低2价,NH3中-3价氮元素被氧化生成-2价的N2H4,化合价至少升高2价,说明次氯酸钠与氨气的物质的量之比为1:2,结合质量守恒配平该反应的化学方程式为:NaClO+2NH3═N2H4+NaCl+H2O,
故答案为:NaClO+2NH3═N2H4+NaCl+H2O.
点评 本题考查离子方程式、化学方程式的书写,题目难度不大,明确发生反应的实质为解答关键,注意掌握氧化还原反应的配平原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
9.图象常作为描述化学过程的一种方法,在化学中大量运用.下列有关图象的说法正确的是( )
| A. | 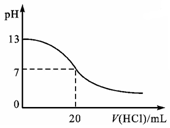 表示V L 0.1mol/L的氨水中滴加某种浓度的盐酸时,溶液pH的变化情况 | |
| B. | 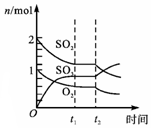 表示SO2与O2的可逆反应,t2时刻条件的改变可能是压强 | |
| C. | 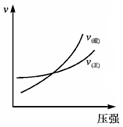 表示一个气体总休积减小的可逆反应中,压强与反应速率的关系 | |
| D. | 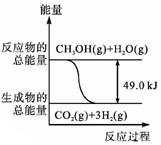 表示某种放热反应,反应热为49.0kJ |
1.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 常温常压下,含有6.02×1024个电子的重水(D2O)的质量约为18g | |
| B. | 常温下,0.5molAl与足量的盐酸反应,转移的电子数约为9.03×1022 | |
| C. | 标况下,17g NH3和22.4LH2O含有相同的电子数 | |
| D. | 50mL0.5mol/L Na2SO4溶液中所含的Na+数目和0.005mol F_所含电子数相同 |
8.下列各项中的两组反应都是在溶液中进行的,它们不能用同一离子方程式表示的是( )
| A. | HCl+Zn,Zn+NaHSO4 | B. | Cu(OH)2+H2SO4,Cu(OH)2+HNO3 | ||
| C. | CaO+HCl,CaO+HNO3 | D. | BaCl2+NaHSO4,Ba(OH)2+NaHSO4(少量) |
18.在25℃时,pH等于3的H2SO4溶液和NH4Cl溶液中,水的电离程度大小比较正确的是( )
| A. | 相等 | B. | 前者比后者大3倍 | ||
| C. | 后者是前者的1011倍 | D. | 后者是前者的108倍 |
5.溶液、胶体和悬浊液这三种分散系的本质区别是( )
| A. | 分散质粒子的大小 | B. | 能否透过滤纸或半透膜 | ||
| C. | 是否为大量分子或离子的集合法 | D. | 能否产生丁达尔效应 |
3.某化合物X 3.2g在氧气中完全燃烧,只生成4.4gCO2和3.6 H2O,下列说法正确的是( )
| A. | 化合物X是烃类物质 | B. | 化合物X的实验式为CH4 | ||
| C. | 化合物X具有多种同分异构体 | D. | 可以确定化合物X的结构式 |