题目内容
根据下表写化学方程式:
| 混合物 | 除杂方法及试剂 |
| Na2CO3 固体(NaHCO3 ) | 加热 |
| NaHCO3溶液(Na2CO3) | 通入足量的CO2气体 |
| Na2CO3溶液(NaHCO3) | 加入适量NaOH溶液 |
考点:化学方程式的书写,钠的重要化合物
专题:
分析:Na2CO3 稳定,受热不分解,NaHCO3不稳定,受热分解生成Na2CO3 、水和CO2;
Na2CO3和水、CO2反应生成NaHCO3;
Na2CO3溶液和NaOH不反应,NaHCO3和NaOH反应生成Na2CO3和水.
Na2CO3和水、CO2反应生成NaHCO3;
Na2CO3溶液和NaOH不反应,NaHCO3和NaOH反应生成Na2CO3和水.
解答:
解:Na2CO3 稳定,受热不分解,NaHCO3不稳定,受热分解生成Na2CO3 、水和CO2,反应方程式为2NaHCO3
Na2CO3+H2O+CO2↑,
Na2CO3和水、CO2反应生成NaHCO3,反应方程式为Na2CO3+H2O+CO2=2NaHCO3;
Na2CO3溶液和NaOH不反应,NaHCO3和NaOH反应生成Na2CO3和水,反应方程式为NaHCO3+NaOH=Na2CO3+H2O,
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;Na2CO3+H2O+CO2=2NaHCO3;NaHCO3+NaOH=Na2CO3+H2O.
| ||
Na2CO3和水、CO2反应生成NaHCO3,反应方程式为Na2CO3+H2O+CO2=2NaHCO3;
Na2CO3溶液和NaOH不反应,NaHCO3和NaOH反应生成Na2CO3和水,反应方程式为NaHCO3+NaOH=Na2CO3+H2O,
故答案为:2NaHCO3
| ||
点评:本题以钠的重要化合物为载体考查化学方程式的书写,根据反应物、生成物及反应条件书写方程式即可,熟练掌握常见元素化合物性质.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案
相关题目
下列溶液中,微粒浓度关系正确的是( )
| A、含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=6的醋酸与醋酸钠的混合溶液中,c(Na+)>c(CH3COO-) |
| C、0.1 mol/L 的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D、pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是c(OH-)=c(H+) |
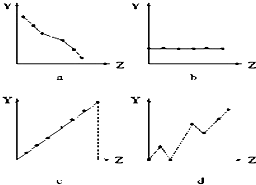 (1)如图曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
(1)如图曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
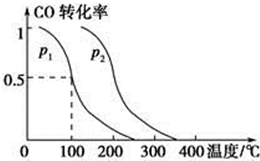 面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景.
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景.