题目内容
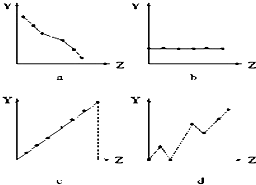 (1)如图曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
(1)如图曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:①ⅡA族元素的价电子数
②第三周期元素的最高化合价
③F-、Na+、Mg2+、Al3+的离子半径
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体.
据此回答:①N的最高价氧化物对应的水化物的化学式为
②工业上制取单质M的化学方程式为
③用电子式表示ZN及X2Y的形成化合物的过程
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)①根据同一主族元素的最外层电子数相等;
②元素的最高正价=最外层电子数=族序数,同一周期元素的最高化合价逐渐增大;
③核外电子数相同,则核内质子数越多,对核外电子的吸引程度越大,半径越小;
(2)Y元素原子最外层电子数与核外电子总数之比为3:4,则最外层电子数为6,核外电子总数为8,故Y为O,M元素原子的最外层电子数与电子层数之比为4:3,则电子层数为3,最外层电子数为4,故M为Si,N-、Z+、X+的半径逐渐减小,故N为氯,Z为钠,XN常温下为气体,X为氢,以此解答.
②元素的最高正价=最外层电子数=族序数,同一周期元素的最高化合价逐渐增大;
③核外电子数相同,则核内质子数越多,对核外电子的吸引程度越大,半径越小;
(2)Y元素原子最外层电子数与核外电子总数之比为3:4,则最外层电子数为6,核外电子总数为8,故Y为O,M元素原子的最外层电子数与电子层数之比为4:3,则电子层数为3,最外层电子数为4,故M为Si,N-、Z+、X+的半径逐渐减小,故N为氯,Z为钠,XN常温下为气体,X为氢,以此解答.
解答:
解:(1)①因同一主族元素的最外层电子数相等,故答案为:b;
②因元素的最高正价=最外层电子数=族序数,同一周期元素的最高化合价逐渐增大,故答案为:c;
③核外电子数相同,则核内质子数越多半径越小,所以离子半径为:F->Na+>Mg2+>Al3+,故答案为:a;
(2)Y元素原子最外层电子数与核外电子总数之比为3:4,则最外层电子数为6,核外电子总数为8,故Y为O,M元素原子的最外层电子数与电子层数之比为4:3,则电子层数为3,最外层电子数为4,故M为Si,N-、Z+、X+的半径逐渐减小,故N为氯,Z为钠,XN常温下为气体,X为氢,
①N为氯元素,它的最高价氧化物对应的水化物的化学式为HClO4,故答案为:HClO4;
②工业上有碳还原二氧化硅制取单质硅,反应的化学方程式为SiO2+2C
Si+2CO↑,故答案为:SiO2+2C
Si+2CO↑;
③ZN为氯化钠,X2Y为水,用电子式表示NaCl及H2O的形成化合物的过程为 、
、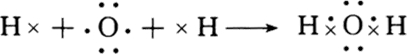 ,
,
故答案为: ;
;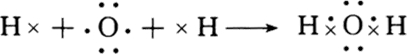 ;
;
②因元素的最高正价=最外层电子数=族序数,同一周期元素的最高化合价逐渐增大,故答案为:c;
③核外电子数相同,则核内质子数越多半径越小,所以离子半径为:F->Na+>Mg2+>Al3+,故答案为:a;
(2)Y元素原子最外层电子数与核外电子总数之比为3:4,则最外层电子数为6,核外电子总数为8,故Y为O,M元素原子的最外层电子数与电子层数之比为4:3,则电子层数为3,最外层电子数为4,故M为Si,N-、Z+、X+的半径逐渐减小,故N为氯,Z为钠,XN常温下为气体,X为氢,
①N为氯元素,它的最高价氧化物对应的水化物的化学式为HClO4,故答案为:HClO4;
②工业上有碳还原二氧化硅制取单质硅,反应的化学方程式为SiO2+2C
| ||
| ||
③ZN为氯化钠,X2Y为水,用电子式表示NaCl及H2O的形成化合物的过程为
 、
、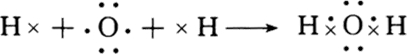 ,
,故答案为:
 ;
;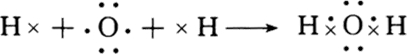 ;
;
点评:本题考查原子结构和元素周期律的关系及应用,题目难度不大,元素推断是解题的关键,答题时注意把握题给信息以及基础知识的灵活运用.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
化学已渗透到人类生活的各个方面.下列说法不正确的是( )
| A、低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
| B、可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| C、可采用将外加电源的正极连接水电站的钢铁闸门上的方式来保护闸门不生锈 |
| D、禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
下列叙述正确的是( )
| A、氕、氘、氚核外电子排布相同,都可作为核聚变的材料 |
| B、1 mol NH4+与23g Na+中含有的质子总数均为11×6.02×1023 |
| C、欲配制1.00 L 1.0 mol?L -1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
| D、电解1 mol熔融的AlCl3,理论上能产生33.6L氯气(标准状况)、27.0g铝 |
下列有关化学用语正确的是( )
A、中子数为18的氯原子结构示意图: | ||
B、质量数为37的氯原子:
| ||
C、Cl-的结构示意图: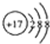 | ||
| D、NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32- |
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中(如图 1),使其发生反应,t0时容器Ⅰ中达到化学平衡,X(g)、Y(g)、Z(g)的物质的量的变化如图2所示.则下列有关推断正确的是( )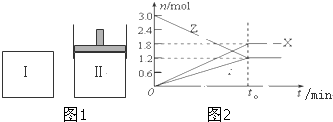

| A、该反应的化学方程式为:3X+2Y?2Z |
| B、若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0 |
| C、两容器中均达到平衡时,Z的物质的量分数相同 |
| D、达平衡后,V(x)为1.8/t0 mol/(L?min) |