题目内容
在25℃下,将a mol?L-1的氨水与0.0lmol?L-l的盐酸等体积混合,反应平衡时溶液中c (NH4+)=c (Cl-).则溶液显 性(填“酸’’、“碱”或“中”);用含a的代数式表示NH3?H2O在25℃时的电离常数Kb= .
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3?H2O的电离常数Kb=
.
| c(OH-)×c(NH4+) |
| c(NH3?H2O) |
解答:
解:在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3?H2O的电离常数Kb=
=
=
,
故答案为:中;
;
| c(OH-)×c(NH4+) |
| c(NH3?H2O) |
| 10-7×5×10-3 |
| 0.5a-5×10-3 |
| 10-9 |
| a-0.01 |
故答案为:中;
| 10-9 |
| a-0.01 |
点评:本题考查弱电解质电离,根据电荷守恒确定溶液酸碱性,结合一水合氨电离平衡常数解答问题,注意二者混合后溶液体积增大一倍,物质浓度降为原来一半,为易错点.题目难度中等.

练习册系列答案
相关题目
下列事实中,不能用勒夏特列原理解释的是( )
| A、盛有NO2和N2O4 混合气体的烧瓶置于热水中,气体颜色变深 |
| B、工业合成氨选择500℃左右的温度比室温有利 |
| C、实验室中常用排饱和食盐水的方法收集Cl2 |
| D、合成氨时采用循环操作及将氨液化分离,可提高原料的利用率 |
符合下列分子式的有机物没有同分异构现象的是( )
| A、CH4 |
| B、C12H22O11 |
| C、C4H10 |
| D、C4H9OH |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.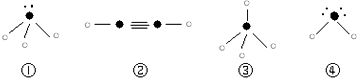
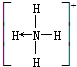 (→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式
(→表示共用电子对由N原子单方面提供). 请画出N4H44+的结构式