题目内容
(B)煤中的硫包括有机硫、硫化物、硫酸盐等,艾士卡法是煤中全硫测定的仲裁法.煤与艾士卡混合试剂(轻质氧化镁和无水碳酸钠以质量比2:1的混合物)混匀混合,在高温、通风条件下缓慢燃烧,使煤中各种形态的硫通过反应,转化成可溶性硫酸盐.相关反应有:
煤+O2→CO2↑+H2O↑+N2↑+SO2↑+SO3; MgO+2SO2+O2=2MgSO4; MgO+SO3=MgSO4;
2Na2CO3+2SO2+O2=2Na2SO4+2CO2↑; Na2CO3+SO3=Na2SO4+CO2↑
沉淀反应:SO42-+Ba2+=BaSO4↓
测定步骤
①称取干燥煤样1g和2g艾士卡试剂放入30ml瓷坩埚(空坩埚质量为m1g)内,用玻璃棒仔细混匀,再加1g艾士卡试剂覆盖在混合物上面.
②将坩埚移入高温炉中,从室温逐渐升温至800~850℃,并在此温度下保持1.5h.
③将坩埚取出放冷,然后将烧结物转到400ml烧杯中,用热水仔细冲洗坩埚内壁.
④过滤,热水冲洗烧杯3次,然后将残渣移入滤纸中,用热水洗涤残渣,滤液总体积约为250~300ml.
⑤向滤液中加2滴指示剂,加入盐酸至过量.将溶液加热至沸,在不断搅拌下滴加氯化钡溶液,再用定量滤纸过滤,并用热水将沉淀洗涤至干净.
⑥将带沉淀的滤纸移入已恒量的瓷坩埚中先进行灰化处理,然后在800~850℃的高温炉中灼烧30min,取出冷却,称量坩埚与固体总质量为m2g.
试回答下列问题
(1)煤直接作燃料燃烧,所引发的主要环境问题是: .
(2)为什么要再用此艾士卡试剂覆盖混合物上面 .
(3)步骤⑤中如何证明滤渣已洗涤干净 .
(4)步骤⑥中为什么可将滤纸及滤渣同时进行灰化处理: .
(5)根据上述实验操作,本次实验测得煤中硫的质量分数为: .
(6)下列过程能使实验结果中,硫的质量分数偏低的是: .
a.煤样不干燥
b.步骤③中煤样未完全烧透
c.步骤④中没有用热水洗涤残渣
d.步骤⑥中高温灼烧时间太短,只进行了5分钟.
煤+O2→CO2↑+H2O↑+N2↑+SO2↑+SO3; MgO+2SO2+O2=2MgSO4; MgO+SO3=MgSO4;
2Na2CO3+2SO2+O2=2Na2SO4+2CO2↑; Na2CO3+SO3=Na2SO4+CO2↑
沉淀反应:SO42-+Ba2+=BaSO4↓
测定步骤
①称取干燥煤样1g和2g艾士卡试剂放入30ml瓷坩埚(空坩埚质量为m1g)内,用玻璃棒仔细混匀,再加1g艾士卡试剂覆盖在混合物上面.
②将坩埚移入高温炉中,从室温逐渐升温至800~850℃,并在此温度下保持1.5h.
③将坩埚取出放冷,然后将烧结物转到400ml烧杯中,用热水仔细冲洗坩埚内壁.
④过滤,热水冲洗烧杯3次,然后将残渣移入滤纸中,用热水洗涤残渣,滤液总体积约为250~300ml.
⑤向滤液中加2滴指示剂,加入盐酸至过量.将溶液加热至沸,在不断搅拌下滴加氯化钡溶液,再用定量滤纸过滤,并用热水将沉淀洗涤至干净.
⑥将带沉淀的滤纸移入已恒量的瓷坩埚中先进行灰化处理,然后在800~850℃的高温炉中灼烧30min,取出冷却,称量坩埚与固体总质量为m2g.
试回答下列问题
(1)煤直接作燃料燃烧,所引发的主要环境问题是:
(2)为什么要再用此艾士卡试剂覆盖混合物上面
(3)步骤⑤中如何证明滤渣已洗涤干净
(4)步骤⑥中为什么可将滤纸及滤渣同时进行灰化处理:
(5)根据上述实验操作,本次实验测得煤中硫的质量分数为:
(6)下列过程能使实验结果中,硫的质量分数偏低的是:
a.煤样不干燥
b.步骤③中煤样未完全烧透
c.步骤④中没有用热水洗涤残渣
d.步骤⑥中高温灼烧时间太短,只进行了5分钟.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)煤中含有硫元素的物质主要是有机硫和无机硫两大类,燃烧会生成二氧化硫气体排放到空气中会形成酸雨;
(2)加1g艾士卡试剂覆盖在混合物上面充分吸收生成的硫的氧化物;
(3)取最后一次洗涤液加入硝酸银检验是否含有氯离子设计检验;
(4)滤纸灰化后留下的灰在高温炉中灼烧后,最终全部转变为气体;
(5)称取干燥煤样1g和2g艾士卡试剂放入30ml瓷坩埚(空坩埚质量为m1g)内,得到坩埚与固体总质量为m2g为硫酸钡沉淀和坩埚的质量,结合硫与守恒计算;
(6)a.煤样不干燥,称量样品质量增大,过程中水变化为气体,测定结果会减小;
b.步骤③中煤样未完全烧透,硫元素未全部反应,称量得到最后沉淀质量减小;
c.步骤④中没有用热水洗涤残渣,会造成最后得到固体质量减小,硫元素减小;
d.步骤⑥中高温灼烧时间太短,只进行了5分钟,滤纸未完全气化,造成沉淀质量增大.
(2)加1g艾士卡试剂覆盖在混合物上面充分吸收生成的硫的氧化物;
(3)取最后一次洗涤液加入硝酸银检验是否含有氯离子设计检验;
(4)滤纸灰化后留下的灰在高温炉中灼烧后,最终全部转变为气体;
(5)称取干燥煤样1g和2g艾士卡试剂放入30ml瓷坩埚(空坩埚质量为m1g)内,得到坩埚与固体总质量为m2g为硫酸钡沉淀和坩埚的质量,结合硫与守恒计算;
(6)a.煤样不干燥,称量样品质量增大,过程中水变化为气体,测定结果会减小;
b.步骤③中煤样未完全烧透,硫元素未全部反应,称量得到最后沉淀质量减小;
c.步骤④中没有用热水洗涤残渣,会造成最后得到固体质量减小,硫元素减小;
d.步骤⑥中高温灼烧时间太短,只进行了5分钟,滤纸未完全气化,造成沉淀质量增大.
解答:
解:(1)煤中含有硫元素的物质主要是有机硫和无机硫两大类,燃烧会生成二氧化硫气体排放到空气中会形成酸雨污染环境,煤直接作燃料燃烧,所引发的主要环境问题是酸雨,
故答案为:酸雨;
(2)煤与艾士卡混合试剂(轻质氧化镁和无水碳酸钠以质量比2:1的混合物)混匀混合,在高温、通风条件下缓慢燃烧,使煤中各种形态的硫通过反应,转化成可溶性硫酸盐,加1g艾士卡试剂覆盖在混合物上面充分吸收生成的硫的氧化物,减少实验误差,
故答案为:保证逸出的硫的氧化物全部被艾士卡试剂吸收,减少实验误差;
(3)取最后一次洗涤液加入硝酸银检验是否含有氯离子设计检验,取最后一次洗涤液少许,加入几滴硝酸银溶液,不产生白色沉淀,
故答案为:取最后一次洗涤液少许,加入几滴硝酸银溶液,不产生白色沉淀;
(4)滤纸灰化后留下的灰在高温炉中灼烧后,最终全部转变为气体,对固体质量称量无影响,不会产生误差,坩埚中剩余的质量即可认为是硫酸钡的质量,
故答案为:滤纸灰化后留下的灰在高温炉中灼烧后,最终全部转变为气体,不影响实验结果,坩埚中剩余的质量即可认为是硫酸钡的质量;
(5)称取干燥煤样1g和2g艾士卡试剂放入30ml瓷坩埚(空坩埚质量为m1g)内,得到坩埚与固体总质量为m2g为硫酸钡沉淀和坩埚的质量,结合硫与守恒计算,硫酸钡质量=(m2-m1)g,则样品煤中硫元素质量分数=
×100%=
×100%;
故答案为:=
×100%;
(6)a.煤样不干燥,称量样品质量增大,过程中水变化为气体,测定结果会减小,故a符合;
b.步骤③中煤样未完全烧透,硫元素未全部反应,称量得到最后沉淀质量减小,故b符合;
c.步骤④中没有用热水洗涤残渣,会造成最后得到固体质量减小,硫元素减小,故c符合;
d.步骤⑥中高温灼烧时间太短,只进行了5分钟,滤纸未完全气化,造成沉淀质量增大,故d不符合;
故答案为:abc.
故答案为:酸雨;
(2)煤与艾士卡混合试剂(轻质氧化镁和无水碳酸钠以质量比2:1的混合物)混匀混合,在高温、通风条件下缓慢燃烧,使煤中各种形态的硫通过反应,转化成可溶性硫酸盐,加1g艾士卡试剂覆盖在混合物上面充分吸收生成的硫的氧化物,减少实验误差,
故答案为:保证逸出的硫的氧化物全部被艾士卡试剂吸收,减少实验误差;
(3)取最后一次洗涤液加入硝酸银检验是否含有氯离子设计检验,取最后一次洗涤液少许,加入几滴硝酸银溶液,不产生白色沉淀,
故答案为:取最后一次洗涤液少许,加入几滴硝酸银溶液,不产生白色沉淀;
(4)滤纸灰化后留下的灰在高温炉中灼烧后,最终全部转变为气体,对固体质量称量无影响,不会产生误差,坩埚中剩余的质量即可认为是硫酸钡的质量,
故答案为:滤纸灰化后留下的灰在高温炉中灼烧后,最终全部转变为气体,不影响实验结果,坩埚中剩余的质量即可认为是硫酸钡的质量;
(5)称取干燥煤样1g和2g艾士卡试剂放入30ml瓷坩埚(空坩埚质量为m1g)内,得到坩埚与固体总质量为m2g为硫酸钡沉淀和坩埚的质量,结合硫与守恒计算,硫酸钡质量=(m2-m1)g,则样品煤中硫元素质量分数=
| ||
| 1g |
| 32(m2-m1) |
| 233 |
故答案为:=
| 32(m2-m1) |
| 233 |
(6)a.煤样不干燥,称量样品质量增大,过程中水变化为气体,测定结果会减小,故a符合;
b.步骤③中煤样未完全烧透,硫元素未全部反应,称量得到最后沉淀质量减小,故b符合;
c.步骤④中没有用热水洗涤残渣,会造成最后得到固体质量减小,硫元素减小,故c符合;
d.步骤⑥中高温灼烧时间太短,只进行了5分钟,滤纸未完全气化,造成沉淀质量增大,故d不符合;
故答案为:abc.
点评:本题考查了物质存在的分析判断,物质除杂实验 方法的分析判断,本质理解应用,掌握物质性质和实验基本操作是解题关键,题目难度中等.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中(如图 1),使其发生反应,t0时容器Ⅰ中达到化学平衡,X(g)、Y(g)、Z(g)的物质的量的变化如图2所示.则下列有关推断正确的是( )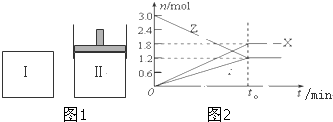

| A、该反应的化学方程式为:3X+2Y?2Z |
| B、若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0 |
| C、两容器中均达到平衡时,Z的物质的量分数相同 |
| D、达平衡后,V(x)为1.8/t0 mol/(L?min) |
下列事实中,不能用勒夏特列原理解释的是( )
| A、盛有NO2和N2O4 混合气体的烧瓶置于热水中,气体颜色变深 |
| B、工业合成氨选择500℃左右的温度比室温有利 |
| C、实验室中常用排饱和食盐水的方法收集Cl2 |
| D、合成氨时采用循环操作及将氨液化分离,可提高原料的利用率 |
胡椒酚是植物挥发油的成分之一,它的结构简式为 ,下列叙述中不 正确的是( )
,下列叙述中不 正确的是( )
 ,下列叙述中不 正确的是( )
,下列叙述中不 正确的是( )| A、胡椒酚在核磁共振中氢光谱有6个波峰 |
| B、胡椒酚与溴水中Br2按1:2反应,可以生成3种有机物 |
| C、胡椒酚可与甲醛发生反应,生成聚合物 |
| D、胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |

 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物 将一定量的氧化铝和氧化铁的混合物完全溶解100mL某浓度的硫酸中,而后向其中逐滴加入1mol/L的NaOH溶液,产生沉淀的量与加入NaOH的体积关系如图(图中横坐标每个格子表示50mL)则:
将一定量的氧化铝和氧化铁的混合物完全溶解100mL某浓度的硫酸中,而后向其中逐滴加入1mol/L的NaOH溶液,产生沉淀的量与加入NaOH的体积关系如图(图中横坐标每个格子表示50mL)则: