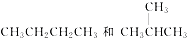题目内容
下列溶液中,微粒浓度关系正确的是( )
| A、含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=6的醋酸与醋酸钠的混合溶液中,c(Na+)>c(CH3COO-) |
| C、0.1 mol/L 的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D、pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是c(OH-)=c(H+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、含有NH4+、Cl-、H+、OH-的溶液中,其组成情况是不同的,根据组成确定离子的浓度;
B、pH=6的醋酸与醋酸钠的混合溶液中,说明醋酸的电离程度大于水解程度,根据电荷守恒来判断;
C、Na2S溶液中,离子的浓度遵循质子守恒;
D、pH=3的一元酸和pH=11的一元碱等体积混和后的溶液的酸碱性和酸碱的强弱有关.
B、pH=6的醋酸与醋酸钠的混合溶液中,说明醋酸的电离程度大于水解程度,根据电荷守恒来判断;
C、Na2S溶液中,离子的浓度遵循质子守恒;
D、pH=3的一元酸和pH=11的一元碱等体积混和后的溶液的酸碱性和酸碱的强弱有关.
解答:
解:A、含有NH4+、Cl-、H+、OH-的溶液中,其组成情况可以是盐酸和氯化铵的混合液,可能存在c(Cl-)>c(H+)>c(NH4+)>c(OH-),故A错误;
B、pH=6的醋酸与醋酸钠的混合溶液中,说明醋酸的电离程度大于水解程度,c(OH-)<c(H+),根据电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+),则c(Na+)<c(CH3COO-),故B错误;
C、Na2S溶液中,遵循质子守恒:c(OH-)=c(H+)+c(HS-)+2c(H2S),故C正确;
D、pH=3的一元酸和pH=11的一元碱等体积混和后的溶液的酸碱性和酸碱的强弱有关,当酸是弱酸时,则c(OH-)<c(H+),碱是弱碱时,c(OH-)>c(H+),只有是强酸强碱时,才存在c(OH-)=c(H+),故D错误.
故选C.
B、pH=6的醋酸与醋酸钠的混合溶液中,说明醋酸的电离程度大于水解程度,c(OH-)<c(H+),根据电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+),则c(Na+)<c(CH3COO-),故B错误;
C、Na2S溶液中,遵循质子守恒:c(OH-)=c(H+)+c(HS-)+2c(H2S),故C正确;
D、pH=3的一元酸和pH=11的一元碱等体积混和后的溶液的酸碱性和酸碱的强弱有关,当酸是弱酸时,则c(OH-)<c(H+),碱是弱碱时,c(OH-)>c(H+),只有是强酸强碱时,才存在c(OH-)=c(H+),故D错误.
故选C.
点评:本题综合考查学生盐的水解、弱电解质的电离以及溶液中离子浓度之间的关系知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
胡椒酚是植物挥发油的成分之一,它的结构简式为 ,下列叙述中不 正确的是( )
,下列叙述中不 正确的是( )
 ,下列叙述中不 正确的是( )
,下列叙述中不 正确的是( )| A、胡椒酚在核磁共振中氢光谱有6个波峰 |
| B、胡椒酚与溴水中Br2按1:2反应,可以生成3种有机物 |
| C、胡椒酚可与甲醛发生反应,生成聚合物 |
| D、胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
符合下列分子式的有机物没有同分异构现象的是( )
| A、CH4 |
| B、C12H22O11 |
| C、C4H10 |
| D、C4H9OH |
下列说法正确的是( )
| A、25℃时,任何稀溶液中由水电离出的c(H+)和c(OH-)的乘积都为1×10-14mol2?L-2 |
| B、氯气溶于水达到平衡后,若其他条件不变,加入少量水,水的电离平衡向逆向移动 |
| C、电解法精炼铜,当阴极质量增加32 g时,有6.02×1023个电子转移 |
| D、含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022 |
 将一定量的氧化铝和氧化铁的混合物完全溶解100mL某浓度的硫酸中,而后向其中逐滴加入1mol/L的NaOH溶液,产生沉淀的量与加入NaOH的体积关系如图(图中横坐标每个格子表示50mL)则:
将一定量的氧化铝和氧化铁的混合物完全溶解100mL某浓度的硫酸中,而后向其中逐滴加入1mol/L的NaOH溶液,产生沉淀的量与加入NaOH的体积关系如图(图中横坐标每个格子表示50mL)则: