题目内容
当可逆反应2SO2+O2?2SO3达到平衡经通入18O2,再次达到平衡时,18O存在于( )
| A、SO2、O2 |
| B、SO2、SO3 |
| C、SO2、SO3、O2 |
| D、SO3、O2 |
考点:化学反应的可逆性
专题:化学平衡专题
分析:从化学键角度来说,化学反应本质是旧键断裂,形成原子,原子重新组合,形成新键.可逆反应不可能100%地全部转化,据此判断.
解答:
解:反应过程中化学键断裂,存在原子有S原子、16O原子、18O原子,原子重新组合生成物质,二氧化硫、氧气在催化剂、加热的条件下,生成三氧化硫;而三氧化硫在同样的条件下可分解为二氧化硫和氧气,所以18O2中的18O通过化合反应存在于SO3中,SO3 中的18O通过分解反应会存在于SO2中,最终SO3、SO2、O2中都含有18O.
故选C.
故选C.
点评:本题以同位素示踪法考查可逆反应的可逆性,比较基础,注意可逆反应不能进行到底,无论进行多长时间,反应物都不可能100%地全部转化为生成物.

练习册系列答案
相关题目
下列物质既含离子键又含共价键的是( )
| A、NO2 |
| B、MgC12 |
| C、HCl |
| D、NaOH |
合成氨反应N2(g)+3H2(g)?2NH3△H<0.能使合成氨反应进行程度增大的方法是( )
| A、升高温度 | B、减低压强 |
| C、使用催化剂 | D、及时分离出氨 |
在一容积为10L的密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得A、B、C三种物质的物质的量如下表.据此判断下列结论中不正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| n(A)/mol | 7 | 3 | 1 | 1 |
| n(B)/mol | 5 | 3 | 2 | 2 |
| n(C)/mol | 1 | 3 | 4 | 4 |
| A、在容器中发生的反应为:2A+B?C |
| B、平衡时A的转化率比B的转化率高 |
| C、在该温度下该反应的化学平衡常数K=200 |
| D、在t1~t2内C物质的平均反应速率为[2/(t2-t1)]mol/(L?s) |
24mL 0.05mol/L的Na2SO3溶液,恰好与20mL 0.02mol/L的K2Cr2O7溶液完全反应,已知Na2SO3被氧化为Na2SO4,则元素Cr在被还原的产物中的化合价是( )
| A、+2 | B、+3 | C、+4 | D、+5 |
下列各组金属均有导线相连,并插入对应的液体中,其中不能组成原电池的是( )
| A、Zn|H2SO4(稀)|Fe |
| B、Cu|AgNO3(aq)|Ag |
| C、Zn|CCl4|Cu |
| D、Fe|H2SO4(稀)|Fe |
下列离子方程式正确的是( )
| A、明矾[KAl(SO4)2?12H2O]净水:Al3++3H2O?Al(OH)3(胶体)+3H+ | ||||
B、以石墨作电极电解熔融的氯化钠:2Cl-+2H2O
| ||||
| C、Na2S水解:S2-+2H2O?H2S+2OH- | ||||
| D、亚硫酸钠溶液中加入硝酸:SO32-+2H+=H2O+SO2↑ |
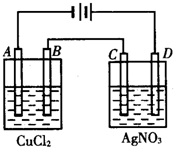 如图为以惰性电极进行电解.完成下列问题
如图为以惰性电极进行电解.完成下列问题