题目内容
合成氨反应N2(g)+3H2(g)?2NH3△H<0.能使合成氨反应进行程度增大的方法是( )
| A、升高温度 | B、减低压强 |
| C、使用催化剂 | D、及时分离出氨 |
考点:化学平衡的影响因素
专题:
分析:使反应进行程度增大,则该反应正向移动,反应为气体体积缩小的且放热,加压、降温、减小生成物的浓度反应正向移动,以此来解答.
解答:
解:A.该反应为放热反应,升高温度,平衡逆向移动,反应进行程度减小,故A不选;
B.该反应为气体体积缩小的反应,降低压强,平衡逆向移动,反应进行程度减小,故B不选;
C.使用催化剂,平衡不移动,不能使反应程度增大,故C不选;
D.及时分离出NH3,平衡正向移动,反应进行程度增大,故D选;
故选D.
B.该反应为气体体积缩小的反应,降低压强,平衡逆向移动,反应进行程度减小,故B不选;
C.使用催化剂,平衡不移动,不能使反应程度增大,故C不选;
D.及时分离出NH3,平衡正向移动,反应进行程度增大,故D选;
故选D.
点评:本题考查化学平衡的移动,明确温度、压强、浓度、催化剂第反应平衡的影响即可解答,注意把握反应的特点,题目难度中等.

练习册系列答案
相关题目
已知:2NO2(g)
2NO(g)+O2(g)△H<0,下列关于该反应的示意图或描述不正确的是( )
| 催化剂 |
| 加热 |
A、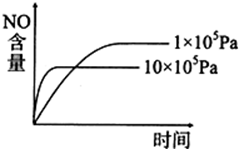 |
B、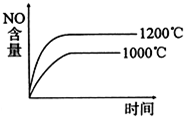 |
| C、NO难溶于水,可以用排水法收集,但不可以用排空气法 |
| D、当生成标准状况下3.36L的氧气时,该反应转移0.6mole |
已知NaHSO4在水中的电离方程式为:NaHSO4═Na++H++SO42-.某温度下,向c(H+)=1×10-6mol/L的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中的c(H+)=1×10-2 mol/L.下列对该溶液的叙述错误的是( )
| A、该温度高于25℃ |
| B、由水电离出来的H+的浓度为1×10-10 mol/L |
| C、NaHSO4晶体的加入抑制了水的电离 |
| D、取该溶液加水稀释100倍,溶液中的c(OH-)减小 |
下列离子方程式书写正确的是( )
| A、浓烧碱溶液中加入铝片:Al+2OH-═AlO2-+H2↑ |
| B、石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O |
| C、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| D、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
下列反应的离子方程式正确的是( )
| A、四氧化三铁固体溶解在稀硝酸溶液中:Fe3O4+8H+═2Fe3++Fe2++4H2O |
| B、少量小苏打溶液滴人Ba(OH)2溶液中:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、硫氢化钠发生水解:HS-+H2O?H3O++S2- |
| D、用少量氨水吸收SO2气体:SO2+2NH3?H2O═2NH4++SO32-+H2O |
当可逆反应2SO2+O2?2SO3达到平衡经通入18O2,再次达到平衡时,18O存在于( )
| A、SO2、O2 |
| B、SO2、SO3 |
| C、SO2、SO3、O2 |
| D、SO3、O2 |
下列物质不能与乙酸反应的是( )
| A、镁 |
| B、CaCl2 |
| C、苛性钠 |
| D、小苏打 |
 锌铜原电池装置如图所示,常常采用电池图式表达式,如:
锌铜原电池装置如图所示,常常采用电池图式表达式,如: