题目内容
在一容积为10L的密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得A、B、C三种物质的物质的量如下表.据此判断下列结论中不正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| n(A)/mol | 7 | 3 | 1 | 1 |
| n(B)/mol | 5 | 3 | 2 | 2 |
| n(C)/mol | 1 | 3 | 4 | 4 |
| A、在容器中发生的反应为:2A+B?C |
| B、平衡时A的转化率比B的转化率高 |
| C、在该温度下该反应的化学平衡常数K=200 |
| D、在t1~t2内C物质的平均反应速率为[2/(t2-t1)]mol/(L?s) |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:A、t1到t2,A、B分别消耗了6mol、3mol,同时生成了3mol的C,反应关系为:2A+B?C;
B、反应前A、B的浓度之比小于2:1,反应过程中消耗的A、B的浓度之比等于2:1,则转化率A的大于B;
C、根据平衡状态,求化学平衡常数;
D、根据公式求算C的反应速率.
B、反应前A、B的浓度之比小于2:1,反应过程中消耗的A、B的浓度之比等于2:1,则转化率A的大于B;
C、根据平衡状态,求化学平衡常数;
D、根据公式求算C的反应速率.
解答:
解:A、根据表中的数据,t1→t2,A、B分别消耗了6mol、3mol,同时生成了3mol的C,故反应方程式为:2A+B?C,故A正确;
B、反应前A、B的浓度之比小于2:1,反应过程中消耗的A、B的浓度之比等于2:1,则转化率A的大于B,故B正确;
C、该温度下该反应的化学平衡常数K=
=
=200,故C正确;
D、t1~t2,C的物质的量变化为2mol,时间为(t2-t1),故C的平均反应速率为:
=
(t2-t1)mol/(L?s),故D错误;
故选D.
B、反应前A、B的浓度之比小于2:1,反应过程中消耗的A、B的浓度之比等于2:1,则转化率A的大于B,故B正确;
C、该温度下该反应的化学平衡常数K=
| c(C) |
| c2(A)c(B) |
| 0.4 |
| 0.12×0.2 |
D、t1~t2,C的物质的量变化为2mol,时间为(t2-t1),故C的平均反应速率为:
| 2mol |
| 10L?(t2-t1)s |
| 1 |
| 5 |
故选D.
点评:本题考查化学反应速率的计算及反应方程式的求算,注意得到了平衡状态,反应没有停止,难度中等.

练习册系列答案
相关题目
对下列有机反应类型的认识中,错误的是( )
A、 +HNO3 +HNO3
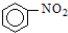 +H2O 取代反应 +H2O 取代反应 | |||
| B、CH2=CH2+Br2→BrCH2CH2Br 加成反应 | |||
C、CH4+Cl2
| |||
D、CH3CH2OH+CH3COOH
|
下列离子方程式书写正确的是( )
| A、浓烧碱溶液中加入铝片:Al+2OH-═AlO2-+H2↑ |
| B、石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O |
| C、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| D、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
下列属于强电解质的是( )
| A、H2S |
| B、CH3COONH4 |
| C、Cu |
| D、NH3?H2O |
当可逆反应2SO2+O2?2SO3达到平衡经通入18O2,再次达到平衡时,18O存在于( )
| A、SO2、O2 |
| B、SO2、SO3 |
| C、SO2、SO3、O2 |
| D、SO3、O2 |
下列有关防护金属腐蚀的说法中,不正确的是( )
| A、青铜(锡铜合金)中的锡可对铜起保护作用 |
| B、在海轮外壳上焊接上锌块,可减缓船体的腐蚀速率 |
| C、海水中钢闸门与电源的正极相连,可以防止闸门的腐蚀 |
| D、钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀的作用 |
生产生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
| A、铜铸塑像上出现铜绿[Cu2(OH)2CO3] |
| B、工业制备氯气 |
| C、金属冶炼 |
| D、服用含Al(OH)3的胃药可以治疗胃酸过多 |
下列说法中可能正确的是( )
| A、标准状况下,pH=7的醋酸和醋酸钠的混合溶液中,c(CH3COO-)=c(Na+) |
| B、pH相同的NH4Cl溶液和硫酸溶液,稀释相同倍数后,硫酸溶液的pH小 |
| C、Ba(NO3)2溶液可以鉴别SO2气体和CO2气体 |
| D、向足量饱和石灰水中加入0.56 g CaO,可析出0.74 g Ca(OH)2固体 |