题目内容
下列离子方程式正确的是( )
| A、明矾[KAl(SO4)2?12H2O]净水:Al3++3H2O?Al(OH)3(胶体)+3H+ | ||||
B、以石墨作电极电解熔融的氯化钠:2Cl-+2H2O
| ||||
| C、Na2S水解:S2-+2H2O?H2S+2OH- | ||||
| D、亚硫酸钠溶液中加入硝酸:SO32-+2H+=H2O+SO2↑ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.明矾电离出的铝离子水解生成氢氧化铝胶体和氢离子;
B.电极熔融的氯化钠生成金属钠和氯气;
C.硫离子的水解分步进行,离子方程式只写出第一步即可;
D.硝酸具有强氧化性,能够将亚硫酸钠氧化成硫酸根离子、NO气体,不会生成二氧化硫气体.
B.电极熔融的氯化钠生成金属钠和氯气;
C.硫离子的水解分步进行,离子方程式只写出第一步即可;
D.硝酸具有强氧化性,能够将亚硫酸钠氧化成硫酸根离子、NO气体,不会生成二氧化硫气体.
解答:
解:A.明矾[KAl(SO4)2?12H2O]净水原理是铝离子水解生成氢氧化铝胶体,水解的离子方程式为:Al3++3H2O?Al(OH)3(胶体)+3H+,故A正确;
B.水解熔融的氯化钠生成的是金属钠和氯气,正确的电解方程式为:2NaCl(熔融)
2Na+Cl2↑,故B错误;
C.硫离子水解的离子方程式需要分步写,一般只写出第一步离子方程式即可,正确的离子方程式为:S2-+H2O?HS-+OH-,故C错误;
D.亚硫酸钠与硝酸发生氧化还原反应生成硫酸钠和NO,正确的离子方程式为:3SO32-+2NO3-+2H+=H2O+3SO42-+2NO↑,故D错误;
故选A.
B.水解熔融的氯化钠生成的是金属钠和氯气,正确的电解方程式为:2NaCl(熔融)
| ||
C.硫离子水解的离子方程式需要分步写,一般只写出第一步离子方程式即可,正确的离子方程式为:S2-+H2O?HS-+OH-,故C错误;
D.亚硫酸钠与硝酸发生氧化还原反应生成硫酸钠和NO,正确的离子方程式为:3SO32-+2NO3-+2H+=H2O+3SO42-+2NO↑,故D错误;
故选A.
点评:本题考查了离子方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确水解原理及水解方程式的书写方法,选项B需要明确是电解熔融氯化钠还是饱和氯化钠,为易错点.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
当可逆反应2SO2+O2?2SO3达到平衡经通入18O2,再次达到平衡时,18O存在于( )
| A、SO2、O2 |
| B、SO2、SO3 |
| C、SO2、SO3、O2 |
| D、SO3、O2 |
下列有关化学用语使用正确的是( )
A、NH4Br的电子式: | ||
B、S的结构示意图: | ||
| C、乙酸的分子式:CH3COOH | ||
D、原子核内有l8个中子的氯原子:
|
下列物质不能与乙酸反应的是( )
| A、镁 |
| B、CaCl2 |
| C、苛性钠 |
| D、小苏打 |
下列说法中可能正确的是( )
| A、标准状况下,pH=7的醋酸和醋酸钠的混合溶液中,c(CH3COO-)=c(Na+) |
| B、pH相同的NH4Cl溶液和硫酸溶液,稀释相同倍数后,硫酸溶液的pH小 |
| C、Ba(NO3)2溶液可以鉴别SO2气体和CO2气体 |
| D、向足量饱和石灰水中加入0.56 g CaO,可析出0.74 g Ca(OH)2固体 |
某有机物x可以还原生成醇,也可以氧化生成一元羧酸,该醇与该羧酸反应可生成分子式为C2H4O2的有机物.则下列说法中不正确的是( )
| A、x由三种元素组成 |
| B、x只有还原性 |
| C、x中含碳40% |
| D、x的分子中有甲基 |

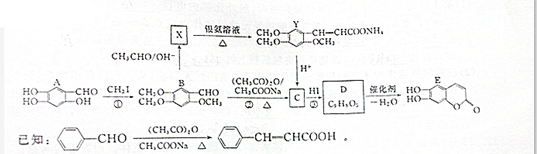
 “来自石油和煤的两种基本化工原料”A和甲.A是气态烃,甲是液态烃;B和D是生活中两种常见的有机物.以A为主要原料合成乙酸乙酯.其合成路线如图所示.
“来自石油和煤的两种基本化工原料”A和甲.A是气态烃,甲是液态烃;B和D是生活中两种常见的有机物.以A为主要原料合成乙酸乙酯.其合成路线如图所示.